题目内容
5.某化学探究学习小组同学在实验室中配制100mL 0.5mol/L的Na2CO3溶液.(1)下列实验步骤是配制溶液所必需的步骤,请使用各步骤的编号按照实验操作时的顺序进行排序(填写各步骤的编号)③⑤①④⑥②⑦;
①溶解 ②定容 ③计算 ④转移 ⑤称量 ⑥洗涤并转移 ⑦反复倒转摇匀
(2)实验中除了需要天平、药匙、烧杯、玻璃棒外,还需要的仪器有胶头滴管,100mL容量瓶;
(3)用碳酸钠晶体(Na2CO3•10H2O)配制该溶液需要14.3g,若称取等质量的Na2CO3,则所配制溶液的浓度偏高(填写偏高、偏低、无影响);
(4)该小组在实验室中发现了一张注射用质量分数为5%的葡萄糖(分子式为C6H12O6,相对分子质量为180)溶液的标签,如图所示:该溶液的物质的量浓度为0.28mol/L(小数点后保留2位数).

分析 (1)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶来对操作顺序进行排序;
(2)根据配制一定物质的量浓度的溶液使用的仪器解答配制450mL溶液,实验室没有该规格的容量瓶,需要选用500mL容量瓶;
(3)根据钠原子守恒可知Na2CO3与Na2CO3•10H2O的物质的量相等,根据m=cvM计算所需Na2CO3•10H2O的质量;若称取等质量的碳酸钠,则溶质的质量偏大;
(4)根据n=$\frac{m}{M}$计算出葡萄糖的物质的量,然后根据C=$\frac{n}{V}$求出物质的量浓度.
解答 解:(1)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶可知正确的操作顺序为:③⑤①④⑥②⑦,故答案为:③⑤①④⑥②⑦;
(2)配制一定物质的量浓度的溶液使用的仪器有:托盘天平(带砝码)、烧杯、玻璃棒、胶头滴管、药匙、100mL容量瓶,
故答案为:胶头滴管,100mL容量瓶;
(3)本实验须称量碳酸钠晶体(Na2CO3•10H2O)的质量为=0.1L×0.5mol•L-1×286g/mol12.5g=14.3g;若称取等质量的碳酸钠,则溶质的质量偏大,所配制的溶液的浓度偏高.
故答案为:14.3;偏高;
(4)葡萄糖的物质的量n=$\frac{m}{M}$=$\frac{12.5g}{180g/mol}$=0.069mol,故物质的量浓度C=$\frac{n}{V}$=$\frac{0.069mol}{0.25L}$=0.28mol/L,故答案为:0.28mol/L.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.

练习册系列答案
相关题目
15.下列叙述正确的是( )
| A. | 金属单质在氧化还原反应中总是作还原剂 | |
| B. | 非金属单质在氧化还原反应中总是作氧化剂 | |
| C. | 钠原子在氧化还原反应中失去1个电子,而铝原子失去3个电子,所以钠的还原性小于铝 | |
| D. | 金属元素被还原时一定生成金属单质 |
16.三硝酸甘油酯是临床上常用的抗心率失常药.合成该药的步骤如下:
1-丙醇$\stackrel{①}{→}$丙烯$→_{500℃}^{Cl_{2}}$3-氯丙烯$\stackrel{Cl_{2}}{→}$②$\stackrel{③}{→}$甘油$\stackrel{④}{→}$三硝酸甘油酯
下列关于上述合成说法正确的是( )
1-丙醇$\stackrel{①}{→}$丙烯$→_{500℃}^{Cl_{2}}$3-氯丙烯$\stackrel{Cl_{2}}{→}$②$\stackrel{③}{→}$甘油$\stackrel{④}{→}$三硝酸甘油酯
下列关于上述合成说法正确的是( )
| A. | ①转化条件是氢氧化钠醇溶液、加热 | |
| B. | 产物②的名称是三氯丙烷 | |
| C. | 由丙烯转化为3-氯丙烯的反应是取代反应 | |
| D. | 三硝酸甘油酯的结构简式为 |
17.某有机物的结构图,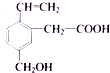 下列说法不正确的是( )
下列说法不正确的是( )
 下列说法不正确的是( )
下列说法不正确的是( )| A. | 能使Br2的四氯化碳溶液褪色 | B. | 能发生酯化反应 | ||
| C. | 该有机物的分子式C11H13O3 | D. | 能与金属钠发生反应 |
14.关于电池,以下叙述不正确的是( )
| A. | 化学电池的反应本质是氧化还原反应 | |
| B. | 最早使用的化学电池是锌锰电池 | |
| C. | 最早使用的充电电池是铅蓄电池 | |
| D. | 二次电池的放电反应与充电反应可能是可逆反应 |
15.下列说法正确的是( )
| A. | 等体积的O2和N2中的分子数相等 | |
| B. | 等温等压的NO和CH4中的分子数相等 | |
| C. | 20℃等压等体积的O2和O3中的分子数相等 | |
| D. | 等压的N2和CO2中的分子数 |

 ,该反应类型为取代反应.
,该反应类型为取代反应. .
. .
. 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s) 设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s) 设计的原电池如图所示.请回答下列问题: