题目内容
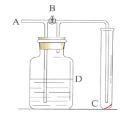
【题目】某同学设计一个燃料电池(如图所示),目的是探究氯碱工业原理和粗铜的精炼原理。

根据要求回答相关问题:
(1)甲装置中,通入氢气的电极为________(填“正极”或“负极”),该极电极反应式为________;若将KOH溶液换成硫酸溶液,则正极电极反应式为__________________________。
(2)关于乙装置,下列说法正确的是________(填序号);
①溶液中Na+向C极移动
②从C极处逸出的气体能使湿润的KI淀粉试纸变蓝
③反应一段时间后通入适量HCl可恢复到电解前电解质的浓度
④若标准状况下Fe极产生2.24L气体,则溶液中转移0.2mol电子
该装置中发生的总反应的离子方程式为__________________________。
(3)乙装置中,X为阳离子交换膜,反应一段时间后交换膜左侧溶液中pH____(填“增大”、“减小”或“不变”);若用饱和MgCl2溶液代替饱和氯化钠溶液,则该装置中发生的总反应______(填“改变”或“不变”)。
(4)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将________(填“增大”“减小”或“不变”),精铜电极上的电极反应式为_______________________________。
【答案】负极 H2-2e-+2OH-=2H2O O2+4e-+4H+=2H2O ②③ 2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑ 增大 改变 减小 Cu2++2e-=Cu
2OH-+H2↑+Cl2↑ 增大 改变 减小 Cu2++2e-=Cu
【解析】
甲池为原电池,氧气发生还原反应,通入氧气的一极为正极,氢气发生还原反应,通入氢气的一极为负极;乙池中Fe电极与负极相连为阴极,石墨电极为阳极;丙池中精铜为阴极,粗铜为阳极。
(1)氢氧燃料电池中氢气发生还原反应,所以通入氢气的一极为负极,电解质溶液为KOH溶液,所以电极方程式为H2-2e-+2OH-=2H2O;正极为通入氧气的一极,若电解质为硫酸,氧气得电子后会生成水,电极方程式为:O2+4e-+4H+=2H2O;
(2)①C极为阳极,电解池中阳离子流向阴极,故错误;
②电解饱和食盐水时阳极上氯离子放电生成氯气,氯气可以使湿润的KI淀粉试纸变蓝,故正确;
③电解饱和食盐水阳极生成氯气,阴极生成氢气,所以反应一段时间后通入适量HCl可恢复到电解前电解质的浓度,故正确;
④电子不能在溶液中转移,故错误;
综上所述答案为②③;
乙装置中右侧阳极反应为:2Cl--2e-=Cl2↑,左侧阴极反应为水电离的氢离子放电:2H++2e-=H2↑,总反应为2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑;
2OH-+H2↑+Cl2↑;
(3)乙装置中右侧阳极反应为:2Cl--2e-=Cl2↑,左侧阴极反应为水电离的氢离子放电:2H++2e-=H2↑,水的电离平衡被破坏,电离出更多的氢氧根,X为阳离子交换膜,所以生成的OH-无法迁移到阳极,所以左侧溶液中pH增大;由于Mg2+会与OH-反应生成沉淀,所以总反应发生改变;
(4)丙池中阴极即精铜上发生反应:Cu2++2e-=Cu,而阳极即粗铜上由于由比铜活泼的金属杂质放电,所以转移相同电子数目时,阳极不能生成与阴极消耗的等量的铜离子,所以硫酸铜溶液浓度减小。

 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案