题目内容
【题目】某校化学研究性学习小组用浓盐酸与二氧化锰加热反应来制取并收集氯气,装置如图: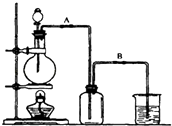
(1)实验开始前,某学生对装置进行了气密性检查.方法是:连接好装置后,用弹簧夹夹住处(填“A”或“B“)橡皮管;向分液漏斗中加水并打开活塞,当加到一定量时,停止加水,静置观察,当观察到分液漏斗中时,表明该装置不漏气.
(2)上述反应中,若有4molHCl参加反应,转移的电子的物质的量是mol.
(3)若实验过程中看到集气瓶中有黄绿色液滴,说明氯气具有的性质是 .
【答案】
(1)B,液面高度不再变化
(2)2
(3)易液化
【解析】解:(1)装置气密性的检查:连接好装置后,用弹簧夹夹住B构成封闭体系,向分液漏斗中加水并打开活塞,漏斗中的液面高度不变,说明气密性良好,故答案为:B;液面(水面)不下降;
故答案为:B; 液面高度不再变化;
(2)依据方程式MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,消耗4mol氯化氢生成1mol氯气,转移2mol电子,
MnCl2+Cl2↑+2H2O,消耗4mol氯化氢生成1mol氯气,转移2mol电子,
故答案为:2;
(3)实验过程中看到集气瓶中有黄绿色液滴,说明氯气具有的性质是易液化,
故答案为:易液化.
(1)根判断装置气密性的操作方法进行回答;
(2)依据方程式计算转移电子数;
(3)氯气沸点高,易液化.

 中考解读考点精练系列答案
中考解读考点精练系列答案【题目】现使用酸碱中和滴定法测定市售白醋的总酸量(g100mL﹣1).
(1)实验步骤
①用(填仪器名称)量取10.00mL食用白醋,在烧杯中用水稀释后转移到100mL(填仪器名称)中定容,摇匀即得待测白醋溶液.
②用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴作指示剂.
③读取盛装0.100 0molL﹣1 NaOH 溶液的碱式滴定管的初始读数.如果液面位置如图所示,则此时的读数为mL.![]()
④滴定.当时,
停止滴定,并记录NaOH溶液的终读数.重复滴定3次.
(2)实验记录
滴定次数实验数据(mL) | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
数据处理与讨论
①按实验所得数据,可得c(市售白醋)=molL﹣1(列式计算);市售白醋总酸量=g100mL﹣1(列式计算).
②在本实验的滴定过程中,下列操作会使实验结果偏大的是填写序号).
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出.