题目内容
已知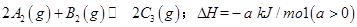 ,在一个有催化剂的固定容积的容器中加入2mol
,在一个有催化剂的固定容积的容器中加入2mol 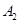 和1mol
和1mol 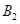 ,在500℃时充分反应达平衡后
,在500℃时充分反应达平衡后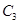 的浓度为w mol/L,放出热量b kJ。
的浓度为w mol/L,放出热量b kJ。
(1)比较a______b(填>、=、<)
(2)下表为不同温度下该反应的平衡常数。由此可推知,表中 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)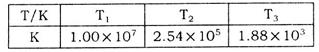
若在原来的容器中,只加入2mol 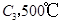 时充分反应达平衡后,吸收热量ckJ,
时充分反应达平衡后,吸收热量ckJ,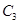 的浓度________(填>、=、<)w mol/L。
的浓度________(填>、=、<)w mol/L。
(3)在相同条件下要想得到2akJ热量,加入各物质的物质的量可能是
A.4mol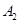 和2mol
和2mol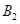 B.4mol
B.4mol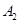 、2mol
、2mol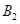 和2mol
和2mol 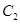
C.4mol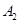 和4mol
和4mol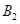 D.6mol
D.6mol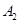 和4mol
和4mol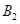
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是___________。
A.及时分离出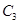 气体 B.适当升高温度
气体 B.适当升高温度
C.增大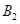 的浓度 D.选择高效的催化剂
的浓度 D.选择高效的催化剂
(1) > (1分) (2)< (1分) = (1分) (3) D (2分) (4) C (2分)
解析试题分析:(1)由于此反应是可逆反应,加入的2molA2和1molB2只能部分反应,故a>b。
(2)该反应为放热反应,温度升高,平衡常数减小,T1时的平衡常数大于T2时的平衡常数,所以T1<T2
(3)在相同条件下要想得到2akJ热量,需要4molA2和2molB2反应,因为该反应为可逆反应,所以加入反应物一定大于4molA2和2molB2,只有D项符合。
(4)A、及时分离出C3气体 ,并不能加快反应速率,错误;B、适当升高温度,化学反应速率增大,因为该反应为放热反应,平衡向逆反应方向移动,错误;C项增大B2的浓度,使该反应的反应速率增大,且平衡向正反应方向移动,正确;D、加入催化剂可以提高反应速率,但不能改变平衡,错误。
考点:本题考查可逆反应的应用、条件对反应速率和化学平衡的影响、反应热。

向2.0L恒容密闭容器中充人1.0mol PCl5,在温度为T时发生如下反应
PCl5(g)  PCl3(g)+C12(g)
PCl3(g)+C12(g)  H=124kJ·mol-1。反应过程中测定的部分数据见下表:
H=124kJ·mol-1。反应过程中测定的部分数据见下表:
| 时间t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCL3)/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 |
回答下列问题
(1)反应在前50 s的平均速率v(PCI5)=________。
(2)温度为T时,该反应的化学平衡常数=________。
(3)要提高上述反应的转化率,可采取的措施有________。
(4)在温度为T时,若起始时向容器中充入0.5mol PCl5和a mol Cl2平衡时PCl5的转化率仍为20%,则a=________。
(5)在热水中,五氯化磷完全水解,生成磷酸(H3 PO4),该反应的化学方程式是________。
若将0.01 mol PCI5投入l L热水中,再逐滴加入AgNO3溶液,先产生的沉淀是________ [已知Ksp(Ag3 PO4)="1.4" x 1 0-16,Ksp(AgCl)="1.8" x 10-10]。
(6)一定条件下,白磷溶于硝酸溶液产生一种氮氧化合物气体,该气体与白磷的物质的量之比为20:3,反应的化学方程式为____________________________。
工业上制备H2的一种重要方法是: CO(g) + H2O(g)  CO2 (g) + H2(g) △H=Q kJ/mol 。已知该反应的平衡常数K与温度T的关系如图所示。若在一固定的密闭容器中, 850℃ 时发生上述反应,测得容器内各物质的浓度 (mol/L)随时间的变化关系如下表:
CO2 (g) + H2(g) △H=Q kJ/mol 。已知该反应的平衡常数K与温度T的关系如图所示。若在一固定的密闭容器中, 850℃ 时发生上述反应,测得容器内各物质的浓度 (mol/L)随时间的变化关系如下表: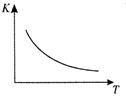
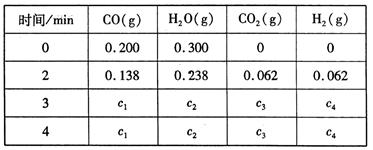
已知:850℃ 时该反应的化学平衡常数K ="1.0" ,请回答下列问题:
(1)Q 0(填“ > ”、“ = ”或“<” )。
(2)可以判断该反应达到化学平衡状态的叙述是 (填字母)。
| A.单位时间内减少 CO(g)的浓度等于生成 CO2 (g)的浓度 |
| B.反应容器内的压强不发生变化 |
| C.混合气体中 H2 (g)的浓度不再发生改变 |
| D.氢气的生成速率等于水的生成速率 |
(4)上表中 c2为 mol/L , CO(g)的转化率为
氮氧化物是空气的主要污染物,消除氮氧化物污染有多种方法。用催化技术可将超音速飞机尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO 2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下测得不同时间的NO和CO浓度如下表:
2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下测得不同时间的NO和CO浓度如下表:
| 时间(s) | 0 | 2 | 4 |
| c(NO) ( mol·L-1) | 1.00×10-3 | 2.50×10-4 | 1.00×10-4 |
| c(CO) ( mol·L-1) | 3.60×10-3 | c’ | 2.70×10-3 |
(1)前4s内的平均反应速率v(NO)= 。c’= 。
(2)当质量一定时,增大固体催化剂的表面积可提高化学反应速率。右图表示在其他条件不变时,上述反应中二氧化碳浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
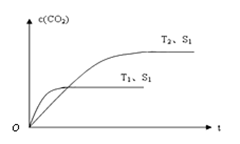
①该反应的ΔH 0(填“>”、“<”或“=”)。
②若催化剂的表面积S1>S2,在答题卡图中画出c(CO2) 在T2、S2条件下达到平衡过程中的变化曲线。
(3)在恒容的密闭容器中,上述反应达到平衡后,改变某一条件,下列示意图正确的是
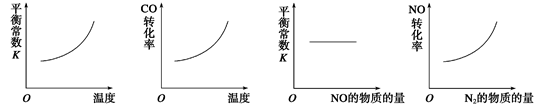
A. B. C. D.
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)  2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K= 。已知:
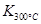 >
>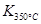 ,则该反应是 热反应。
,则该反应是 热反应。(2)图中表示NO2的变化的曲线是 。用O2表示从0~2 s内该反应的平均速率v= 。
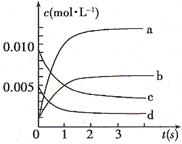
(3)能说明该反应已达到平衡状态的是 。
A.v(NO2)=2v(O2)
B.容器内压强保持不变
C.NO、O2、NO2的浓度之比为2:1:2
D.容器内密度保持不变
E.容器内气体的颜色不再变化
(4)缩小容器体积使压强增大,平衡向 反应方向移动(填“正”或“逆”),K值 (填“增大”、“减小”或“不变”)
 2NH3(g) △H<0,起始 充入amol N2、bmol H2, 达到平衡后,N2、H2、NH3的物质的量分别为1 mol、3 mol、10 mol,回答下列问题:
2NH3(g) △H<0,起始 充入amol N2、bmol H2, 达到平衡后,N2、H2、NH3的物质的量分别为1 mol、3 mol、10 mol,回答下列问题: Ni(CO)4(g)+Q
Ni(CO)4(g)+Q Ni(s)+4CO(g)
Ni(s)+4CO(g) xC(g),2min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 mol/L,请填写下列空白:
xC(g),2min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 mol/L,请填写下列空白: 2CO(g) △H>0
2CO(g) △H>0