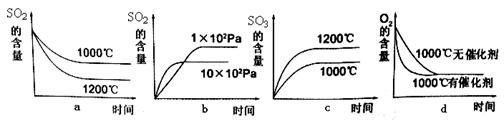
题目内容
氮氧化物是空气的主要污染物,消除氮氧化物污染有多种方法。用催化技术可将超音速飞机尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO 2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下测得不同时间的NO和CO浓度如下表:
2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下测得不同时间的NO和CO浓度如下表:
| 时间(s) | 0 | 2 | 4 |
| c(NO) ( mol·L-1) | 1.00×10-3 | 2.50×10-4 | 1.00×10-4 |
| c(CO) ( mol·L-1) | 3.60×10-3 | c’ | 2.70×10-3 |
(1)前4s内的平均反应速率v(NO)= 。c’= 。
(2)当质量一定时,增大固体催化剂的表面积可提高化学反应速率。右图表示在其他条件不变时,上述反应中二氧化碳浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
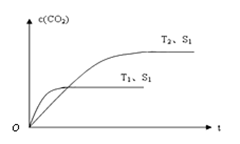
①该反应的ΔH 0(填“>”、“<”或“=”)。
②若催化剂的表面积S1>S2,在答题卡图中画出c(CO2) 在T2、S2条件下达到平衡过程中的变化曲线。
(3)在恒容的密闭容器中,上述反应达到平衡后,改变某一条件,下列示意图正确的是
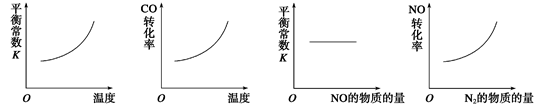
A. B. C. D.
(1)2.25×10-4 mol/(L·s) 2.85×10-3 mol/L (各2分,共4分)
(2)① < (2分)
② (3分,①曲线画错不得分:注意起始点、变化趋势、拐点;②曲线正确但不标条件扣1分) (3) C (3分)
(3分,①曲线画错不得分:注意起始点、变化趋势、拐点;②曲线正确但不标条件扣1分) (3) C (3分)
解析试题分析:(1)根据表中数据可知,前4s内NO的浓度变化量=1.00×10-3mol/L-1.00×10-4mol/L=9.00×10-4mol/L,所以NO的平均反应速率v(NO)=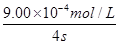 =2.25×10-4 mol/(L·s)。前2s内NO浓度减少了1.00×10-3mol/L-2.50×10-4mol/L=7.50×10-4mol/L。根据方程式可知,消耗CO的浓度=7.50×10-4mol/L,所以此时CO的浓度=3.60×10-3 mol/L-7.50×10-4mol/L=2.85×10-3 mol/L。
=2.25×10-4 mol/(L·s)。前2s内NO浓度减少了1.00×10-3mol/L-2.50×10-4mol/L=7.50×10-4mol/L。根据方程式可知,消耗CO的浓度=7.50×10-4mol/L,所以此时CO的浓度=3.60×10-3 mol/L-7.50×10-4mol/L=2.85×10-3 mol/L。
(2)①根据图像可知,在固体催化剂的表面积不变的情况下,温度为T1的曲线首先达到平衡状态。温度高反应速率快,到达平衡的时间少。因此温度是T1>T2。但温度高平衡时CO2的浓度降低,这说明升高温度平衡向逆反应方向移动,因此正方应是放热反应,即△H<0。
②当质量一定时,增大固体催化剂的表面积可提高化学反应速率,但催化剂不能改变平衡状态。所以若催化剂的表面积S1>S2,则在温度为T2时,达到平衡的时间增加,但平衡状态不变,因此图像为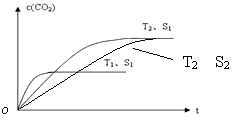 。
。
(3)A、正方应是放热反应,升高温度平衡向逆反应方向移动,平衡常数减小,A不正确;B、正方应是放热反应,升高温度平衡向逆反应方向移动,CO的转化率降低,B不正确;C、平衡常数只与温度有关,增大NO的浓度,平衡向正反应方向移动,但平衡常数不变,C正确;D、增大生物物氮气的浓度,平衡向逆反应方向移动,NO的转化率降低,D不正确,答案选C。
考点:考查反应速率的计算、外界条件对平衡状态的影响以及图像识别

 阅读快车系列答案
阅读快车系列答案在1.0 L密闭容器中放入0.10 mol A (g),在一定温度进行如下反应:A(g)  B(g)+C(g) ΔH=+85.1 kJ·mol-1
B(g)+C(g) ΔH=+85.1 kJ·mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p /100 kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为________。
(2)由总压强p和起始压强p0计算反应物A的转化率α(A)的表达式为________________________________________________________________________,平衡时A的转化率为________,列式并计算反应的平衡常数K_______________。
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n总=________mol,n(A)=________mol。
②下表为反应物A浓度与反应时间的数据,计算a=__________________。
| 反应时间t/h | 0 | 4 | 8 | 16 |
| c(A)/(mol·L-1) | 0.10 | a | 0.026 | 0.006 5 |
分析该反应中反应物的浓度c(A)变化与时间间隔(Δt)的规律,得出的结论是________,由此规律推出反应在12 h时反应物的浓度c(A)为________mol·L-1。
将水煤气转化成合成气,然后合成各种油品和石化产品是化工的极为重要的领域。除去水蒸气后的水煤气主要含H2、CO、CO2及少量的H2S、CH4,继续除去H2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气。
(1)制水煤气的主要化学反应方程式为:C(s)+H2O(g) CO(g)+H2(g),此反应是吸热反应。
CO(g)+H2(g),此反应是吸热反应。
①此反应的化学平衡常数表达式为 。
②下列能增大碳的转化率的措施是 。
| A.加入C(s) | B.加入H2O(g) | C.升高温度 | D.增大压强 |
 CO(g)+2H2O(g) ΔH="-519" kJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
CO(g)+2H2O(g) ΔH="-519" kJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)①X在750℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在600℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在440℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知根据上述信息,你认为在生产中应该选择的适宜催化剂是 (填“X”、“Y”或“Z”),选择的理由是 。
甲醇被称为2l世纪的新型燃料,工业上通过下列反应I和II,用CH4和H2O为原料来制备甲醇:
CH4(g)+H2O(g)  CO(g)+3H2 (g)……I CO(g)+2H2(g)
CO(g)+3H2 (g)……I CO(g)+2H2(g) 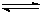 CH3OH(g) ……II。
CH3OH(g) ……II。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入容积为100L反应室,在一定条件下发生反应I,CH4的平衡转化率与温度、压强的关系如图。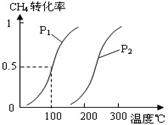
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为____________________。
②图中的P1_________P2(填“<”、“>”或“=”),100℃时平衡常数的值为__________ 。
(2)在压强为0.1 MPa条件下, 将a mol CO与 3a mol H2的混合气体在催化剂作用下,自发反应Ⅱ,生成甲醇。
③该反应的△H ____ 0;若容器容积不变,下列措施可增加甲醇产率的是________。
| A.升高温度 | B.将CH3OH(g)从体系中分离 |
| C.充入He,使体系总压强增大 | D.再充入1mol CO和3mol H2 |
| 实验编号 | T(℃) | N(CO)/n(H2) | P(Mpa) |
| i | 150 | 1/3 | 0.1 |
| ii | | | 5 |
| iii | 350 | | 5 |
a.请在上表空格中填入剩余的实验条件数据。
b.根据反应II的特点,在给出的坐标图中,画出在5MPa条件下CO的转化率随温度变化的趋势曲线示意图,并标明压强。
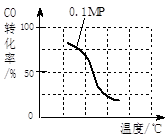
 。
。 Cr2O72—(橙色)+H2O。
Cr2O72—(橙色)+H2O。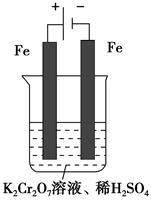
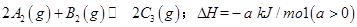 ,在一个有催化剂的固定容积的容器中加入2mol
,在一个有催化剂的固定容积的容器中加入2mol 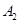 和1mol
和1mol 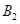 ,在500℃时充分反应达平衡后
,在500℃时充分反应达平衡后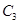 的浓度为w mol/L,放出热量b kJ。
的浓度为w mol/L,放出热量b kJ。 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)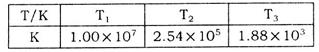
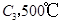 时充分反应达平衡后,吸收热量ckJ,
时充分反应达平衡后,吸收热量ckJ,
 C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。
C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。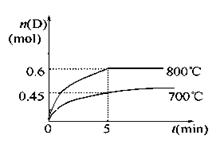
 H2+I2
H2+I2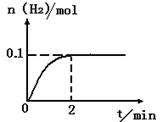
 2SO3(g) + Q,若此反应起始的物质的量相同,则下列关系图正确的是_________ (填序号)
2SO3(g) + Q,若此反应起始的物质的量相同,则下列关系图正确的是_________ (填序号)