��Ŀ����
��2.0L�����ܱ������г���1.0mol PCl5�����¶�ΪTʱ�������·�Ӧ
PCl5(g)  PCl3(g)+C12(g)
PCl3(g)+C12(g)  H=124kJ��mol-1����Ӧ�����вⶨ�IJ������ݼ��±���
H=124kJ��mol-1����Ӧ�����вⶨ�IJ������ݼ��±���
| ʱ��t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCL3��/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 |
�ش���������
��1����Ӧ��ǰ50 s��ƽ������v(PCI5)=________��
��2���¶�ΪTʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��=________��
��3��Ҫ���������Ӧ��ת���ʣ��ɲ�ȡ�Ĵ�ʩ��________��
��4�����¶�ΪTʱ������ʼʱ�������г���0.5mol PCl5��a mol Cl2ƽ��ʱPCl5��ת������Ϊ20������a=________��
��5������ˮ�У����Ȼ�����ȫˮ�⣬��������(H3 PO4)���÷�Ӧ�Ļ�ѧ����ʽ��________��
����0.01 mol PCI5Ͷ��l L��ˮ�У�����μ���AgNO3��Һ���Ȳ����ij�����________ [��֪Ksp(Ag3 PO4)="1.4" x 1 0-16��Ksp(AgCl)="1.8" x 10-10]��
��6��һ�������£���������������Һ����һ�ֵ������������壬��������������ʵ���֮��Ϊ20��3����Ӧ�Ļ�ѧ����ʽΪ____________________________��
��1��0.0016 mol/( L��s) ��2��0.025
��3�������¶ȣ���ѹǿ������PCl3��Cl2�Ⱥ����𰸣�
��4��0.1 ��5��PCl5+4H2O = H3PO4+5HCl AgCl
��6��3P4 + 20HNO3 + 8H2O = 12H3PO4 + 20NO��
���������������1����Ӧ��ǰ50 s��ƽ������v(PCI3)=��c/��t=0.16mol��2.0L��50s=0.0016mol/(L��s).����v(PCI5)= v(PCI3)= 0.0016 mol/( L��s).�ɱ������ݿ��Կ��������¶�ΪT������Ӧ�ﵽƽ��ʱ��n(PCI3)=" 0.2mol" ,n(C12)=0.2mol.,n(PCI5)=0.8mol.����c(PCI5)=0.4mol/L;c(PCI3)=0.1mol/L;c(C12)=0.1mol/L,���Ի�ѧƽ�ⳣ��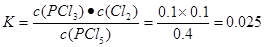 .��3�����ڸ÷�Ӧ������ӦΪ���������������ȷ�Ӧ������Ҫ���������Ӧ��ת���ʣ��ɲ�ȡ�Ĵ�ʩ�м�Сѹǿ���������¶Ȼ��ƽ�������з����PCl3��Cl2�ȴ�ʩ����4��������ʼʱ�������г���0.5mol PCl5��a mol Cl2������ƽ��ʱPCl5��ת������Ϊ20������ﵽƽ��ʱn(PCl5)=0.4mol;n(PCl3)=0.1mol;n(Cl2)= (0.1+a)molc(PCl5)=" 0.2mol/L," c(PCl3) =0.05mol/Lc(Cl2)="(0.1+a)/2L"
.��3�����ڸ÷�Ӧ������ӦΪ���������������ȷ�Ӧ������Ҫ���������Ӧ��ת���ʣ��ɲ�ȡ�Ĵ�ʩ�м�Сѹǿ���������¶Ȼ��ƽ�������з����PCl3��Cl2�ȴ�ʩ����4��������ʼʱ�������г���0.5mol PCl5��a mol Cl2������ƽ��ʱPCl5��ת������Ϊ20������ﵽƽ��ʱn(PCl5)=0.4mol;n(PCl3)=0.1mol;n(Cl2)= (0.1+a)molc(PCl5)=" 0.2mol/L," c(PCl3) =0.05mol/Lc(Cl2)="(0.1+a)/2L"  .���a=0.1mol����5������ˮ�У����Ȼ�����ȫˮ�⣬��������(H3 PO4)�Ļ�ѧ����ʽ��PCl5+4H2O = H3PO4+5HCl������0.01 mol PCI5Ͷ��l L��ˮ���������Cl-��Ũ��Ϊc(Cl-)=0.05mol/L����H3PO4��������ʣ�c(PO43-) <<0.01mol/L. ��������μ���AgNO3��Һ����Ҫ����AgCl��������6����������ɵ÷���ʽΪ��3P4 + 20HNO3 + 8H2O = 12H3PO4 + 20NO��
.���a=0.1mol����5������ˮ�У����Ȼ�����ȫˮ�⣬��������(H3 PO4)�Ļ�ѧ����ʽ��PCl5+4H2O = H3PO4+5HCl������0.01 mol PCI5Ͷ��l L��ˮ���������Cl-��Ũ��Ϊc(Cl-)=0.05mol/L����H3PO4��������ʣ�c(PO43-) <<0.01mol/L. ��������μ���AgNO3��Һ����Ҫ����AgCl��������6����������ɵ÷���ʽΪ��3P4 + 20HNO3 + 8H2O = 12H3PO4 + 20NO��
���㣺���黯ѧ��Ӧ���ʡ���ѧƽ�ⳣ������������Ի�ѧƽ���ƶ���Ӱ���֪ʶ��

�ô�����̼��ƺ�ϡ���ᷴӦ��ȡ������̼���壬��ش�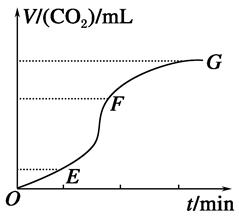
��1��ʵ�������ͼ��ʾ�������жϣ�__________�λ�ѧ��Ӧ������죬________���ռ��Ķ�����̼������ࡣ
��2��Ϊ�˼���������Ӧ�Ļ�ѧ���ʣ�������Һ�м����������ʣ�����Ϊ���е���________������ĸ��ţ���
| A������ˮ | B��NaCl���� | C��NaCl��Һ | D��Ũ���� |
25 ��ʱ�������Ϊ2 L���ܱ������У���̬A��B��C�����ʵ���n��ʱ��t�ı仯��ͼ1��ʾ����֪�ﵽƽ������¶ȣ�A��ת���ʽ�����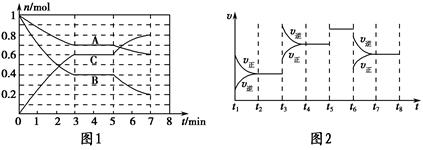
| t2��t3 | t4��t5 | t5��t6 | t7��t8 |
| K1 | K2 | K3 | K4 |
��1������ͼ1���ݣ�д���÷�Ӧ�Ļ�ѧ����ʽ��__________________���˷�Ӧ��ƽ�ⳣ������ʽK��________���ӷ�Ӧ��ʼ����һ��ƽ��ʱ��ƽ������v��A��Ϊ________��
��2����5��7 min�ڣ���Kֵ���䣬��˴����߱仯��ԭ����________________��
��3����ͼ2��ʾ�˷�Ӧ�ķ�Ӧ����v��ʱ��t�Ĺ�ϵͼ�����ε�ƽ�ⳣ�������ʾ��K1��K2��K3��K4֮��Ĺ�ϵΪ________���á�>������<���������ӣ���A��ת��������һ��ʱ����________��
��ˮú��ת���ɺϳ�����Ȼ��ϳɸ�����Ʒ��ʯ����Ʒ�ǻ����ļ�Ϊ��Ҫ������ȥˮ�������ˮú����Ҫ��H2��CO��CO2��������H2S��CH4��������ȥH2S�ɲ��ô���Ǵ�ת����������CH4ת����CO���õ�CO��CO2��H2�Ļ�����壬������ĺϳɼ״�ԭ������
(1)��ˮú������Ҫ��ѧ��Ӧ����ʽΪ��C(s)+H2O(g) CO(g)+H2(g)���˷�Ӧ�����ȷ�Ӧ��
CO(g)+H2(g)���˷�Ӧ�����ȷ�Ӧ��
�ٴ˷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ ��
������������̼��ת���ʵĴ�ʩ�� ��
| A������C(s) | B������H2O(g) | C�������¶� | D������ѹǿ |
 CO(g)+2H2O(g) ��H="-519" kJ/mol����ҵ��Ҫѡ����ʵĴ������ֱ��X��Y��Z���ִ�����������ʵ��(����������ͬ)
CO(g)+2H2O(g) ��H="-519" kJ/mol����ҵ��Ҫѡ����ʵĴ������ֱ��X��Y��Z���ִ�����������ʵ��(����������ͬ)��X��750��ʱ��Ч����ߣ���ʹ����Ӧ���ʼӿ�Լ3��105����
��Y��600��ʱ��Ч����ߣ���ʹ����Ӧ���ʼӿ�Լ3��105����
��Z��440��ʱ��Ч����ߣ���ʹ�淴Ӧ���ʼӿ�Լ1��106����
��֪����������Ϣ������Ϊ��������Ӧ��ѡ������˴����� (�X������Y����Z��)��ѡ��������� ��
��10 L���ܱ������У��������»�ѧ��Ӧ��CO2��g����H2��g�� CO��g����H2O��g���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
CO��g����H2O��g���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
| t/�� | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
��ش�
��1���÷�ӦΪ ������ȡ����ȡ�����Ӧ��
��2���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK �� ��
��3����˵���÷�Ӧ�ﵽ��ѧƽ��״̬���� ������ĸ����
a��������CO2����������H2�� b��������CO����������H2O��
c��������H2����������H2O�� d��������H2����������H2��
��4��ij�¶��£���CO2��H2��0.10 mol����������У��ﵽƽ���� c��CO��="0.0080" mol��L-1����CO2��ת����Ϊ ��
��5��ij�¶��£�ƽ��Ũ�ȷ�����ʽ��c��CO2����c��H2����c��CO����c��H2O�������жϴ�ʱ���¶�Ϊ �档
 ��
�� Cr2O72��(��ɫ)��H2O��
Cr2O72��(��ɫ)��H2O��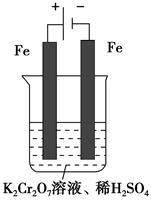
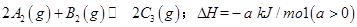 ����һ���д����Ĺ̶��ݻ��������м���2mol
����һ���д����Ĺ̶��ݻ��������м���2mol 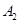 ��1mol
��1mol 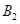 ����500��ʱ��ַ�Ӧ��ƽ���
����500��ʱ��ַ�Ӧ��ƽ���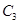 ��Ũ��Ϊw mol/L���ų�����b kJ��
��Ũ��Ϊw mol/L���ų�����b kJ�� ���������������������
���������������������
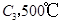 ʱ��ַ�Ӧ��ƽ�����������ckJ��
ʱ��ַ�Ӧ��ƽ�����������ckJ��
 H2+I2
H2+I2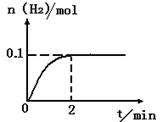
 2SO3(g) + Q�����˷�Ӧ��ʼ�����ʵ�����ͬ�������й�ϵͼ��ȷ����_________ (�����)
2SO3(g) + Q�����˷�Ӧ��ʼ�����ʵ�����ͬ�������й�ϵͼ��ȷ����_________ (�����)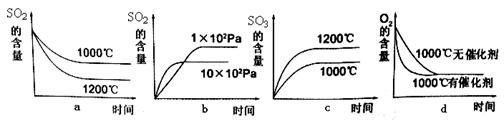
 N2O4(g) ��H= -52.7kJ��mol-1��ij����С��Ϊ��̽���¶Ⱥ�ѹǿ�Ի�ѧƽ���Ӱ�죬������������ʵ�飺
N2O4(g) ��H= -52.7kJ��mol-1��ij����С��Ϊ��̽���¶Ⱥ�ѹǿ�Ի�ѧƽ���Ӱ�죬������������ʵ�飺