题目内容
【题目】对下列探究反应速率和化学平衡影响因素的四个实验,回答下列问题:
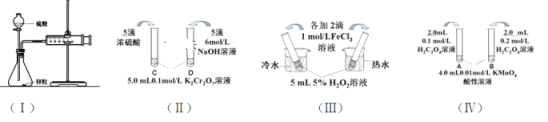
(1)利用实验(Ⅰ)探究锌与1mol/L硫酸和4mol/L硫酸反应的速率,可以测定收集一定体积氢气所用的时间。①此方法需要控制的变量有(至少写出两项):___。②为了衡量反应的快慢,还可以采用新的测定方法是_____。
(2)实验(Ⅱ)已知:Cr2O72- (橙色)+ H2O![]() 2CrO42-(黄色)+ 2H+。D试管中实验现象为_______________________________,用平衡移动原理解释原因:_______________________
2CrO42-(黄色)+ 2H+。D试管中实验现象为_______________________________,用平衡移动原理解释原因:_______________________
(3)实验(Ⅲ)①实验目的是探究____________________。
(4)在室温下进行实验(Ⅳ)①实验目的是_____。②溶液褪色的时间:t(A)________t(B)(填>、<或= )
【答案】温度,锌粒大小 测定相同时间内收集到的气体体积 溶液由橙黄色变为黄色 加NaOH溶液使c(H+)减小,平衡右移,c(CrO42-)增大 探究温度对反应速率的影响 探究浓度对反应速率的影响 >
【解析】
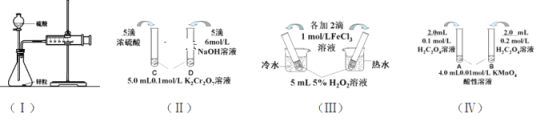
(1)①探究影响反应速率的因素,需要在同等条件下,研究单一变量对速率的影响,则此方法需要控制的变量是相同温度和锌粒大小;
②为了衡量反应的快慢,还可以采用新的测定方法是测定相同时间内收集到的气体体积或收集相同体积的气体需要的时间;
(2)已知:Cr2O72- (橙色)+ H2O![]() 2CrO42-(黄色)+ 2H+。D试管中滴加NaOH溶液使c(H+)减小,平衡右移,c(CrO42-)增大,则实验现象为溶液由橙黄色变为黄色;
2CrO42-(黄色)+ 2H+。D试管中滴加NaOH溶液使c(H+)减小,平衡右移,c(CrO42-)增大,则实验现象为溶液由橙黄色变为黄色;
(3)实验(Ⅲ)是在相同浓度情况下,不同温度对反应速率的影响,则实验目的是探究探究温度对反应速率的影响;
(4)①是在室温下进行实验(Ⅳ),但反应物的浓度不同,则实验目的是探究浓度对反应速率的影响;
②浓度越大,反应速率越快,则溶液褪色的时间:t(A) >t(B);

【题目】温度为T 时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,
反应:PCl5(g)![]() PCl3(g)+Cl2(g)经一段时间后达到平衡,反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡,反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 250 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是
A. 反应在前50 s内的平均速率v(PCl3)=0.0032mol/(L·s)
B. 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol/L,该反应为放热反应
C. 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,达到平衡前的v正>v逆
D. 相同温度下,起始时向容器中充入2.0 mol PCl3、2.0 mol Cl2,达到平衡时,PCl3的转化率小于80%
【题目】反应速率和化学反应的限度是化学反应原理的重要组成部分。
(1)探究反应条件对0.10 mol/L Na2S2O3溶液与0.10 mol/L稀H2SO4反应速率的影响。反应方程式为:Na2S2O3+H2SO4 = Na2SO4+S↓+SO2↑+H2O。设计测定结果如下:
编号 | 反应温度/℃ | Na2S2O3溶液/mL | 水/mL | H2SO4溶液/mL | 乙 |
① | 25 | 10.0 | 0 | 10.0 | x |
② | 25 | 5.0 | a | 10.0 | y |
③ | 40 | 10.0 | 0 | 10.0 | z |
若上述实验①②是探究浓度对化学反应速率的影响,则a为______,乙是实验需要测量的物理量,则表格中“乙”为________________________,x、y、z的大小关系是_______________________。
(2)氨气具有广泛的用途,工业上合成氨的反应是N2(g) +3H2(g) ![]() 2NH3(g)
2NH3(g)
①已知:
化学键 | H—H | N≡N | N—H | 键能kJ/mol(断开1mol化学键所需要的能量) | 436 | 945 | 391 |
则合成氨的热化学方程式是__________________________________________________。
②一定温度下,在一个容积固定的密闭容器中若反应起始时N2、H2、NH3的浓度分别为0.1 mol/L、0. 3 mol/L、0.1 mol/L,达到平衡时NH3浓度c(NH3)的范围是________________________。
③ 下列说法中,能说明上述②中反应已经达到化学平衡状态的是_________________。
a. 1mol N≡N键断裂的同时,有6mol N-H键断裂 b. N2、NH3物质的量浓度不再改变 c. 容器中气体的密度保持不变 d. 容器内N2、 H2物质的量之比为1:3,且保持不变 e. 2 v正(NH3)=3 v逆 (H2)
④在工业生产中,及时分离出NH3,有利于合成氨,用平衡移动原理解释原因是_______________________。