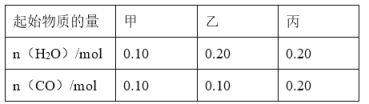
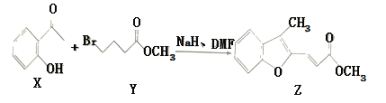
题目内容
【题目】2019年6月6日,工信部正式向四大运营商颁发了5G商用牌照,揭示了我国5G元年的起点。通信用锂离子电池般需要体积小、重量轻、高温性能突出、可高倍率充放电、绿色环保等众多优点。请回答下列问题:
(1)LiCoO2、LiFePO4 常用作锂离子电池的正极材料。基态Fe原子的价电子排布式为___基态Co原子核外电子的空间运动状态有_______种。
(2)PO43-的空间构型是______,写出与其互为等电子体的一种阴离子______,基态P原子的第一电离能为什么比基态S原子的第一电离能大:______。
(3)现有化学式为Co(NH3)5Cl3的配合物,1mol 该物质最多可以与2molAgNO3反应,则该配合物中钴的配位数为______, 配体中N的杂化方式为_____,1mol 该配合物中含δ键数目为______NA。
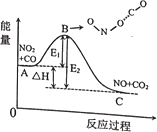
(4)FeO是离子晶体,其晶格能可通过下图的Bom-Haber循环计算得到。气态电中性基态原子获得一个电子变为气态一价负离子放出的能量叫做第一电子亲和能,由图可知O原子的第一电子亲和能为_____kJ·mol-1, FeO晶格能为_____kJ·mol-1。

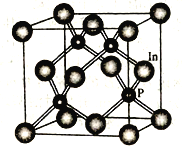
(5)单质锂晶体的结构如下图,晶胞中锂的配位数为____,晶胞的空间利用率为____(用含有n的表达式即可),若晶胞边长为a pm, NA为阿伏加德罗常数,则金属锂的密度为_____ g cm-3。(写出计算式)

【答案】3d64s2 15 正四面体 SO42-或ClO4-等 P原子的3p轨道是半充满状态,比较稳定,所以P原子的第一电离能比S的大 6 sp3 21 142 3902 8 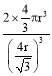 或
或![]()
![]() 或
或![]()
【解析】
(1)根据构造原理, Fe26号元素,属于第四周期第Ⅷ族,基态原子的价电子排布式为3d64s2;核外电子的空间运动状态指的是电子轨道,基态Co原子由1s、2s、2p(3个轨道)、3s、3p(3个轨道)、3d(5个轨道)、4s,故基态Co原子核外电子的空间运动状态有15种;
(2)根据价层电子对互斥理论,PO43-的价层电子对数为4,空间构型是正四面体;等电子体指的是原子个数相同且价电子数相同的分子或离子,故与PO43互为等电子的阴离子由SO42、S2O32、ClO4 等等(答案合理即可);基态P原子的价电子排布3s23p3,基态S原子3s23p4,P的3p轨道处于半满能量较低较稳定,不易失去电子,基态P原子的第一电离能比基态S原子的第一电离能大;
(3)1molCo(NH3)5Cl3配合物质最多与2molAgNO3反应,故可以写为[Co(NH3)5Cl]Cl2,则该配合物中内界中5个氨分子和1个氯离子均为中心钴离子的配体,故该配合物中钴的配位数为6; 配体中N以单键形式与H键和,故杂化方式为sp3;每个该配合物中有6个配位键(也属于δ键),每个氨分子由3个δ键,共含有δ键数目3×5+6=21,则含有1mol 该配合物中含δ键数目为21NA;
(4)根据第一电子亲和能的定义,由图可知气态电中性基态氧原子O(g)得一个电子变为气态一价负离子O(g)放出的热量142kJ·mol-1,故O原子的第一电子亲和能为142kJ·mol-1;根据定义,FeO晶格能是指在标准状况下,使离子晶体FeO变成气态正离子Fe2+(g)和负离子O2-(g)时所吸收的能量3902kJ·mol-1,因此由图可知FeO晶格能为3902kJ·mol-1;
(5)单质锂晶体是体心立方堆积,晶胞中锂的配位数为8;根据堆积方式确定体对角线上的原子相切,故晶胞边长a与原子半径r的关系为![]() a=4r,晶胞的空间利用率=100%×
a=4r,晶胞的空间利用率=100%×![]() =
=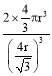 =
=![]() ;NA为阿伏加德罗常数,由原子均摊法计算得该晶胞中有2个K原子,则晶胞的质量为2×
;NA为阿伏加德罗常数,由原子均摊法计算得该晶胞中有2个K原子,则晶胞的质量为2×![]() ,边长apm=
,边长apm=![]() cm,故金属锂的密度为
cm,故金属锂的密度为![]() 或
或![]() 。
。

【题目】下列各选项中,物质之间通过一步反应就能实现如图所示变化的是( )
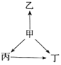
选项 | 甲 | 乙 | 丙 | 丁 |
A | Al | AlCl3 | Al2O3 | NaAlO2 |
B | S | H2S | SO2 | SO3 |
C | Na | Na2O | NaOH | Na2O2 |
D | N2 | NH3 | NO | NO2 |
A. AB. BC. CD. D
【题目】硼镁泥是一种工业废料,主要成分是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
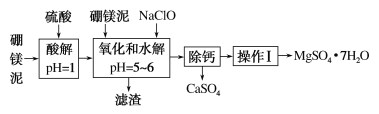
根据题意回答下列问题:
(1)实验中需用1 mol·L-1的硫酸800 mL,若用18.4 mol·L-1的浓硫酸来配制,量取浓硫酸时,需使用的量筒的规格为________。
A 10 mL B 20 mL C 50 mL D 100 mL
(2)加入的NaClO可将Mn2+氧化为MnO2,反应的离子方程式为:___________________,还有一种离子也会被NaClO氧化,反应的离子方程式为______________________。
(3)滤渣的主要成分中除含有Fe(OH)3、Al(OH)3外还有_______________。
(4)在“除钙”前,需检验滤液中Fe3+是否被除尽,简述检验方法:____________________。
(5)已知MgSO4、CaSO4的溶解度如下表:
温度/℃ | 40 | 50 | 60 | 70 |
S(MgSO4)/g | 30.9 | 33.4 | 35.6 | 36.9 |
S(CaSO4)/g | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4的混合溶液中的CaSO4除去,根据上表数据,可确定操作步骤为蒸发结晶、________________(填操作名称)。
(6)实验中提供的硼镁泥共10 g,得到MgSO4·7H2O共17.22 g,则MgSO4·7H2O的产率为________。