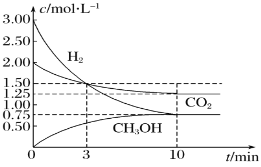
题目内容
【题目】![]() 晶体的晶胞结构与
晶体的晶胞结构与![]() 晶体的相似(如下图所示),但
晶体的相似(如下图所示),但![]() 晶体中由于哑铃形
晶体中由于哑铃形![]() 的存在,使晶胞沿一个方向拉长。则关于
的存在,使晶胞沿一个方向拉长。则关于![]() 晶体的描述不正确的是( )
晶体的描述不正确的是( )
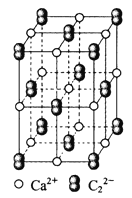
A.![]() 晶体的熔点较高,硬度也较大
晶体的熔点较高,硬度也较大
B.与![]() 距离相同且最近的
距离相同且最近的![]() 构成的多面体是正六面体
构成的多面体是正六面体
C.与![]() 距离相同且最近的
距离相同且最近的![]() 有4个
有4个
D.上图的结构中共含有4个![]() 和4个
和4个![]()
【答案】B
【解析】
A.CaC2晶体是由Ca2+和C22-形成的离子晶体,离子晶体的熔点较高,硬度也较大,故A正确;
B.根据晶胞结构图知,以最中心钙离子为例,由于晶胞沿一个方向拉长,Ca2+周围距离最近且等距离的C22-分布在这个钙离子同一层的正方形的棱边的中点上,上底面面心上和下底面面心上的两个C22-与钙离子的距离大于同一层上的4个C22-与钙离子的距离,所以1个Ca2+周围距离最近的C22-有4个,4个C22-构成正方形,故B错误;
C.根据晶胞结构图知,以最中心钙离子为例,由于晶胞沿一个方向拉长,Ca2+周围距离最近且等距离的C22-分布在这个钙离子同一层的正方形的棱边的中点上,上底面面心上和下底面面心上的两个C22-与钙离子的距离大于同一层上的4个C22-与钙离子的距离,所以1个Ca2+周围距离最近的C22-有4个,故C正确;
D.根据晶胞结构图知,C22-的个数为8×![]() +6×
+6×![]() =4,Ca2+的个数为12×
=4,Ca2+的个数为12×![]() +1=4,故D正确;
+1=4,故D正确;
故选B。

 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案【题目】磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。废旧电池正极片(磷酸亚铁锂、炭黑和铝箔等)可再生利用,其工艺流程如下:

已知:碳酸锂在水中的溶解度,0℃时为1.54g,90℃时为0.85g,100℃时为0.71g。
(1)上述流程中至少需要经过______次过滤操作。
(2)“氧化”发生反应的离子方程式为__________;若用HNO3代替H2O2不足之处是_____。
(3)①已知Ksp[Fe(OH)3]=2.6×10-39。常温下,在Fe(OH)3悬浊液中,当溶液的pH=3.0时,Fe3+的浓度为________mol/L。
②实际生产过程中,“调节pH”生成沉淀时,溶液pH与金属元素的沉淀百分率(ω)的关系如下表:
pH | 3.5 | 5.0 | 6.5 | 8.0 | 10.0 | 12.0 |
ω(Fe)/% | 66.5 | 79.2 | 88.5 | 97.2 | 97.4 | 98.1 |
ω(Li)/% | 0.9 | 1.3 | 1.9 | 2.4 | 4.5 | 8.0 |
则最佳的沉淀pH=________。
(4)“沉锂" 时的温度应选(填标号)______为宜,并用___洗涤(填“热水" 或“冷水")。
a.90℃ b.60 ℃ c.30 ℃ d.0 ℃
(5)磷酸亚铁锂电池在工作时,正极发生LiFePO4和FePO4的转化,该电池放电时正极的电极反应式为________。
(6)工业上可以用FePO4、Li2CO3和H2C2O4作原料高温焙烧制备 LiFePO4,该反应的化学方程式为________
【题目】现有短周期元素性质的部分数据如下表,其中x的值表示不同元素的原子吸引电子的能力大小,若x值越大,元素的非金属性越强,金属性越弱。x值相对较大的元素在所形成的分子中化合价为负。⑩原子的核外电子层数与核外电子总数相同。
元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
x | 3.44 | 2.55 | 0.98 | 3.16 | 2.19 | 3.98 | 0.93 | 3.04 | 1.91 | |
常见化合价 | 最高价 | +4 | +1 | +1 | +4 | |||||
最低价 | -2 | -1 | -3 | -1 | -3 | |||||
(1)根据以上条件,推断③④⑤的元素符号分别为:___,__,__。
(2)②的最高价氧化物的固体属于__晶体,空间构型__。
(3)用电子式表示下列原子相互结合成的化合物电子式:
①+⑦+⑩:___,
①+⑩形成原子个数比为1:1的化合物:__。
(4)写出①与⑦所形成仅含离子键的化合物和④与⑩所形成的化合物反应的离子方程式:___。