题目内容
【题目】(1)已知:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) ΔH=-115. 6 kJ·mol-1, H2(g)+Cl2(g)=
2Cl2(g)+2H2O(g) ΔH=-115. 6 kJ·mol-1, H2(g)+Cl2(g)=
2HCl(g)ΔH=-184 kJ·mol-1。
①H2与O2反应生成气态水的热化学方程式是___________。
②断开1 mol H—O键所需能量为______ kJ。
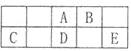
③高温下H2O可分解生成分子或原子。高温下水分解体系中主要气体的体积分数与温度的关系如图所示。图中A、B表示的物质依次是________,物质的量之比为2:1的A、H2化学能较低的物质是________。

(2)已知ΔG=ΔH—T·ΔS。在100 kPa、298. 15 K时石灰石分解反应CaCO3(s)= CaO(s)+CO2(g)的ΔH=+178. 3 kJ·mol-1,ΔS=+160. 4 J·mol-1·K-1
①从吉布斯自由能变(ΔG)的角度说明该反应高温下能自发进行的原因___________________。
②则该反应自发进行的最低温度为__________K。
【答案】2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1 462.9 H、O(或氢原子、氧原子) H2 反应为吸热、熵增反应,常温下ΔG>0,反应不自发 1111.6 K
【解析】
Ⅰ①已知:①4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) ΔH=-115. 6 kJ·mol-1,②H2(g)+Cl2(g)=2HCl(g)ΔH=-184 kJ·mol-1;据盖斯定律①+②×2得:2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1 ;综上所述,本题答案是:2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1。
2Cl2(g)+2H2O(g) ΔH=-115. 6 kJ·mol-1,②H2(g)+Cl2(g)=2HCl(g)ΔH=-184 kJ·mol-1;据盖斯定律①+②×2得:2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1 ;综上所述,本题答案是:2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1。
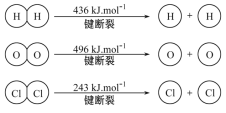
②反应热=反应物断键吸收的总能量-生成物成键放出的总能量,据已知键能,反应2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1中有4×436+496-4Q(H-O)=-483.6,所以氢氧键的键能为462.9 kJ·mol-1;因此,本题正确答案是: 462.9。
③由图可以知道,水的分解过程中,化学键断裂先生成H原子与O原子,氢原子结合生成氢气,氧原子结合生成氧气,由水的分子式可以知道氢原子物质的量是氧原子2倍,故A为氢原子、B为氧原子;分子拆成原子要吸收能量,氢原子能量高于氢分子;因此,本题正确答案是: H、O(或氢原子、氧原子);H2 。
(2)①298.15K时,△H-T△S=+178.3kJ·mol-1-298.15K×160.4×10-3kJ·mol-1·K-1=+130.5kJ·mol-1>0,故常温下该反应不能自发进行;综上所述,本题答案是:反应为吸热、熵增反应,常温下ΔG>0,反应不自发。
②当△H-T△S=0时,T=ΔH/ΔS=178.3/160.4×10-3= 1111.6 K ,故当T>1111.6K时,△H-T△S<0,反应才能自发;综上所述,本题答案是:1111.6 K。

 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案