题目内容
【题目】下列图示与对应的叙述正确的是( )
A.  若要除去CuSO4溶液中的Fe3+,需要调节溶液的pH在7左右
若要除去CuSO4溶液中的Fe3+,需要调节溶液的pH在7左右
B.  表示反应4CO(g)+2NO2(g)N2(g)+4CO2(g),保持其他条件不变,改变CO的物质的量,平衡时N2的体积分数变化情况。由图可知,NO2的转化率:c>b>a
表示反应4CO(g)+2NO2(g)N2(g)+4CO2(g),保持其他条件不变,改变CO的物质的量,平衡时N2的体积分数变化情况。由图可知,NO2的转化率:c>b>a
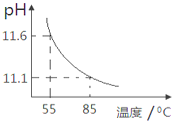
C.  表示25℃时,分别加水稀释体积均为100 mL、pH=2的CH3COOH溶液和HX溶液,则25℃时HX的电离平衡常数大于CH3COOH的电离平衡常数
表示25℃时,分别加水稀释体积均为100 mL、pH=2的CH3COOH溶液和HX溶液,则25℃时HX的电离平衡常数大于CH3COOH的电离平衡常数
D.  表示25℃时,向0.1 molL﹣1的NH4Cl溶液中滴加0.1 molL﹣1的盐酸,溶液中c(H+)/c(NH4+)随盐酸体积的变化关系
表示25℃时,向0.1 molL﹣1的NH4Cl溶液中滴加0.1 molL﹣1的盐酸,溶液中c(H+)/c(NH4+)随盐酸体积的变化关系
【答案】BD
【解析】
A. 图示显示在pH = 4 时Fe3+完全沉淀,pH = 6 时Cu2+完全沉淀,据此分析;
B. 转化率 = ![]() ×100 %,结合平衡向正向移动分析作答;
×100 %,结合平衡向正向移动分析作答;
C. 弱电解质越弱越电离;
D. NH4Cl水解显酸性,加盐酸抑制其水解。
A. 在pH = 4 时Fe3+完全沉淀,Cu2+开始沉淀,则要除去CuSO4溶液中的Fe3+,需要调节溶液的pH在4左右,故A项错误;
B. 根据反应4CO(g)+2NO2(g) ![]() N2(g)+4CO2(g)可知,保持其他条件不变,增大CO的物质的量,反应正向移动,即NO2的转化率增大,则NO2的转化率:c>b>a,故B项正确;
N2(g)+4CO2(g)可知,保持其他条件不变,增大CO的物质的量,反应正向移动,即NO2的转化率增大,则NO2的转化率:c>b>a,故B项正确;
C. 从图中可以看出,体积均为100 mL、pH=2的CH3COOH溶液和HX溶液,加水稀释相同量时HX的pH增大曲线较为平缓,则说明HX的酸性比CH3COOH弱,即25 ℃时HX的电离平衡常数大于CH3COOH的电离平衡常数,故C项错误;
D. NH4Cl在溶液中发生水解,其方程式为:NH4+ +H2O![]() NH3·H2O + H+,向0.1 mol·L-1的NH4Cl溶液中滴加0.1 mol·L-1的盐酸时,随盐酸体积的增大,混合溶液中酸性增强,且NH4+的水解抑制程度加大,则c(H+)/c(NH4+)的比值逐渐增大,与图像相符,故D项正确;
NH3·H2O + H+,向0.1 mol·L-1的NH4Cl溶液中滴加0.1 mol·L-1的盐酸时,随盐酸体积的增大,混合溶液中酸性增强,且NH4+的水解抑制程度加大,则c(H+)/c(NH4+)的比值逐渐增大,与图像相符,故D项正确;
答案选BD。