题目内容
【题目】W、M、X、Y、Z是周期表前36号元素中的五种常见元素,其原子序数依次增大。W的一种核素在考古时常用来鉴定一些文物的年代;M的氧化物是导致酸雨的主要物质之一。X的某一种单质是大气污染物监测物之一;Y的基态原子核外有6个原子轨道处于半充满状态;Z能形成红色的Z2O和黑色的ZO两种氧化物。
(1)Y3+基态的电子排布式可表示为___。
(2)MX![]() 的空间构型__(用文字描述)。
的空间构型__(用文字描述)。
(3)MH3极易溶于水的原因是___。
(4)根据等电子原理,WX分子的结构式为___。
(5)1molWX2中含有的σ键数目为__。
(6)H2X分子中X原子轨道的杂化类型为___。
(7)向Z2+的溶液中加入过量NaOH溶液,可生成Z的配位数为4的配位离子,该配位离子为___。
【答案】1s22s22p63s23p63d3(或[Ar]3d3) 平面三角形 NH3分子与H2O分子间形成氢键 C≡O 2×6.02×1023个(或2NA) sp3杂化 Cu(OH)![]()
【解析】
根据题干信息可知:W、M、X、Y、Z是周期表前36号元素,其原子序数依次增大,W的一种核素在考古时常用来鉴定一些文物的年代,故W为C;M的氧化物是导致酸雨的主要物质之一,M可能是N或者S,X的某一种单质是大气污染物监测物之一则X为O,故M只能是N;Y的基态原子核外有6个原子轨道处于半充满状态即3d54s1,故Y为Cr;Z能形成红色的Cu2O和黑色的CuO两种氧化物,故Z为Cu;综上所述:W、M、X、Y、Z分别是C、N、O、Cr、Cu五种元素。
(1)Y为Cr,故Y3+基态的电子排布式可表示为1s22s22p63s23p63d3(或[Ar]3d3),答案为:1s22s22p63s23p63d3(或[Ar]3d3);
(2)MX![]() 即NO
即NO![]() ,由于NO
,由于NO![]() 中N原子形成了三个σ键且没有孤对电子,其与三氟化硼是等电子体,故其的空间构型为平面三角形,答案为:平面三角形;
中N原子形成了三个σ键且没有孤对电子,其与三氟化硼是等电子体,故其的空间构型为平面三角形,答案为:平面三角形;
(3)MH3即NH3极易溶于水的原因是由于NH3与H2O均为极性分子,二者相似相溶,且NH3分子与H2O分子间形成氢键,故答案为:由于NH3与H2O均为极性分子,二者相似相溶,且NH3分子与H2O分子间形成氢键;
(4)根据等电子原理,WX即CO分子与N2互为等电子体,故CO的结构式为C≡O,答案为:C≡O;
(5)根据WX2即CO2的结构简式O=C=O可知,1mol中含有CO2的σ键数目为2mol,答案为:2×6.02×1023个(或2NA);
(6)H2X分子即H2O中O原子与H原子形成2个σ键,且O周围有2对孤对电子,故其杂化类型为sp3杂化,答案为:sp3;
(7)Cu2+与OH-之间形成配位键,又知生成Z的配位数为4的配位离子,故该配位离子为Cu(OH)![]() ,答案为:Cu(OH)
,答案为:Cu(OH)![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】关于铝热反应的现象有如下描述:反应放出大量的热,并发出耀眼的光芒;纸漏斗的下部被烧穿,有熔融物落入沙中。已知![]() 、
、![]() 、
、![]() 、
、![]() 的熔点、沸点如表所示:
的熔点、沸点如表所示:
物质 |
|
|
|
|
熔点/℃ | 660 | 1565 | 2054 | 1535 |
沸点/℃ | 2467 | 3414 | 2980 | 2750 |
(1)某同学推测,铝热反应所得到的熔融物是铁铝合金,因为该反应放热能使铁熔化,而铝的熔点比铁的低,此时液态的铁和铝形成铁铝合金。你认为他的解释是否合理?________(填“合理”或“不合理”)。
(2)设计一个简单的实验,证明上述熔融物中含有金属铝,填写下列表格:
①所用试剂 | ______ |
②实验操作及现象 | ______ |
③有关反应的化学方程式 | ______ |
(3)欲在常温下溶解该熔融物,下列试剂中最好选用______(填序号),理由是_________________________。
a.浓硫酸 b.稀硫酸 c.硫酸锌溶液d. ![]() 溶液
溶液
【题目】X、Y、Z、W四种元素的部分信息如下表所示。
元素 | X | Y | Z | W |
相关 信息 | 短周期元素,最高化合价为+7价 | 基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子 | 核外电子共有15种运动状态 | 能与X形成两种常见化合物WX2、WX3,酚遇WX3溶液能发生显色反应 |
回答下列问题:
(1)W的基态原子电子排布式为___,X、Y、Z三种元素电负性由大到小的顺序为___(用具体的元素符号填写)。
(2)化合物YX4、ZX3、ZX5(气态或液态时)中,中心原子的轨道类型不是sp3杂化的是___ (填化学式,下同),分子构型是正四面体的是___,ZX3属于___(极性分子、非极性分子)。
(3)已知WX3的熔点:306℃,沸点:319℃,则WX3的晶体类型为___。
(4)Z原子的价电子轨道表示式为___。
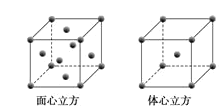
(5)W元素的单质晶体在不同温度下有两种堆积方式,晶胞分别如图所示。在面心立方晶胞中W原子的配位数为___;若W的原子半径为rcm,阿伏加德罗常数为NA,则其体心立方晶体的密度可表示为___gcm-3。