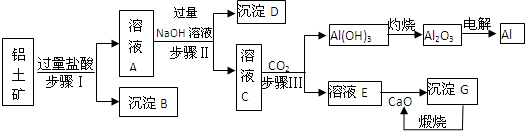
题目内容
2.“神州八号”飞船成功发射升空之后,完成了与1个月前发射的“天宫一号”的成功交会对接,其中新材料铝锂合金为“太空之吻”提供了保障.下列关于铝锂合金的认识正确的( )| A. | 铝锂合金是铝与锂形成的一种化合物 | |
| B. | 锂是碱金属元素,性质活泼,铝锂合金与水反应生成氢气 | |
| C. | 铝离子和锂离子的核外电子排布相同 | |
| D. | 若铝锂合金中锂含量为1.1%,则127.3g铝锂合金中含有锂原子0.2mol |
分析 A.铝锂合金属于混合物;
B.锂铝合金性质稳定,可用作航天材料;
C.铝离子含有3个电子层,锂离子含有2个电子层;
D.根据质量及锂的质量分数计算出锂的质量,再根据n=$\frac{m}{M}$计算出锂的物质的量.
解答 解:A.铝锂合金为金属铝和金属锂的混合物,不是化合物,故A错误;
B.锂铝合金的化学性质比较稳定,可用作制作航天材料,所以不会与水反应生成氢气,故B错误;
C.铝离子的核电荷数为103,核外电子总数为10,而锂离子的核电荷数为3,核外电子总数为2,二者的核外电子排布不相同,故C错误;
D.合金中锂含量为1.1%,127.3g铝锂合金中含有锂的质量为:127.3g×1.1%=1.4003g,则含有锂原子的物质的量为:$\frac{1.4003g}{7g/mol}$=0.2mol,故D正确;
故选D.
点评 本题考查了铝、碱金属的化学性质及合金的判断,题目难度中等,明确铝、碱金属的化学性质为解答关键,注意掌握合金的概念及具有的性质,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
12.下列物质用途的叙述中,不正确的是( )
| A. | 硅可以用作制造太阳能电池 | B. | 二氧化硅可以用于制造光导纤维 | ||
| C. | 石墨可用作绝缘材料 | D. | 石英晶体可用于制造光学仪器 |
13.青奥中心外墙的复合保温材料采用铝合金锁边.有关铝合金的性质正确的是( )(填字母).
| A. | 强度小 | B. | 耐腐蚀 | C. | 密度大 |
10.下列化合物中含有2个手性碳原子的是( )
| A. | 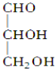 | B. | 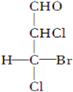 | C. | 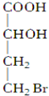 | D. | 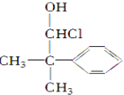 |
11.下列过程中△H大于零的是( )
| A. | 碳的燃烧 | B. | 葡萄糖在人体内氧化分解 | ||
| C. | Ba(OH)2•8H2O与NH4Cl反应 | D. | 锌粒与稀H2SO4反应制取H2 |
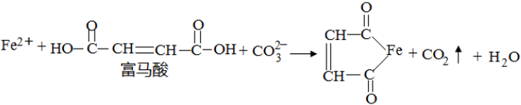

 .
.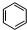 +Cl2$\stackrel{FeCl_{3}}{→}$
+Cl2$\stackrel{FeCl_{3}}{→}$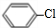 +HCl.
+HCl.