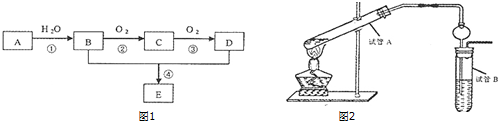
题目内容
3.(NH4)2Fe(SO4)2属于盐类,溶于水后会电离出NH4+和Fe2+,写出检验的操作和现象:(1)检验Fe2+:取少量样品于试管中,加入硫氰酸钾溶液无现象,加入氯水后,溶液若呈血红色则证明含有亚铁离子;
(2)检验NH4+:取适量样品于试管中,加入浓NaOH溶液并加热,用湿润的红色石蕊试纸置于试管口,试纸变蓝.
分析 (1)Fe2+的检验方法:取少量样品于试管中,加入硫氰酸钾溶液无现象,加入氯水溶液变为血红色或加入NaOH溶液,先产生白色沉淀,然后变成灰绿色最终变成红褐色;
(2)NH4+的检验方法:取少量样品于试管中,加入浓NaOH溶液并加热,用湿润的红色石蕊试纸置于试管口,试纸变蓝.
解答 解:(1)Fe2+的检验方法:取少量样品于试管中,加入硫氰酸钾溶液无现象,加入氯水溶液变为Fe3+,硫氰酸钾溶液呈血红色,即Fe3++3SCN-?Fe(SCN)3;故答案为:加入硫氰酸钾溶液无现象,加入氯水后,溶液若呈血红色则证明含有亚铁离子;
(2)NH4+的检验方法:取少量样品于试管中,加入浓NaOH溶液并加热,用湿润的红色石蕊试纸置于试管口,试纸变蓝,故答案为:加入浓NaOH溶液并加热,用湿润的红色石蕊试纸置于试管口,试纸变蓝.
点评 本题主要考查的是常见阳离子的检验,亚铁离子的检验一定要排除铁离子的干扰,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.已知铅蓄电池的总反应为:Pb(s)+PbO2(s)+2H2SO4(aq) $?_{充电}^{放电}$2PbSO4(s)+2H2O(l)市场上一种手提应急灯,主要是“无液干粉”铅蓄电池,其原理是将浓硫酸灌注到硅胶凝胶中去,改善了电池的性能.下列说法不正确的是( )
| A. | 放电时,电子由Pb通过外电路转移到PbO2 | |
| B. | 充电时阴极反应:PbSO4+2e-=Pb(s)+SO42-(aq) | |
| C. | 充电时,电源的正极接铅蓄电池标“-”的一极 | |
| D. | “无液干粉”铅蓄电池中的电解质溶液不易发生泄漏 |
14.海水是宝贵的自然资源,将海水淡化与浓海水资源化结合起来是综合利用海水的重要途径之一.
(1)采用“空气吹出法”从浓海水吹出Br2,并用纯碱吸收,这样做的目的是使Br2富集;碱吸收溴的主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3,吸收0.15mol Br2时,转移的电子为0.25mol.
(2)海水提镁的一段工艺流程如图:
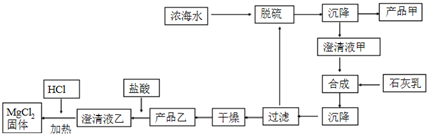
浓海水的主要成分如下:
①该工艺过程中,脱硫阶段主要的离子方程式为Ca2++SO42-=CaSO4↓,加入石灰乳时所发生的离子方程式是Mg2++Ca(OH)2=Mg(OH)2↓+Ca2+
②产品乙的化学式为Mg(OH)2,1L浓海水最多可得到产品乙的质量是69.9g.
(1)采用“空气吹出法”从浓海水吹出Br2,并用纯碱吸收,这样做的目的是使Br2富集;碱吸收溴的主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3,吸收0.15mol Br2时,转移的电子为0.25mol.
(2)海水提镁的一段工艺流程如图:

浓海水的主要成分如下:
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
②产品乙的化学式为Mg(OH)2,1L浓海水最多可得到产品乙的质量是69.9g.
15.某消毒液的主要成分为NaClO,还含有一定量的NaOH,下列叙述正确的是( )
| A. | 用pH试纸测得该消毒液的pH约为12 | |
| B. | 该消毒液中,Fe3+、K+、NO${\;}_{3}^{-}$、CH3CHO可以大量共存 | |
| C. | 向该消毒液中滴入少量Na2SO3溶液,反应的离子方程为:SO${\;}_{3}^{2-}$+ClO-=Cl-+SO${\;}_{4}^{2-}$ | |
| D. | 向该消毒液中加入浓盐酸,每产生1mol Cl2,转移电子数约为2×6.02×1023 |