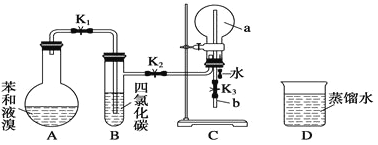
题目内容
【题目】银锌电池是一种常见化学电源,其反应原理为Zn+Ag2O+H2O=Zn(OH)2+2Ag,其工作示意图如下。下列说法不正确的是 ( )
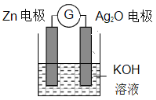
A. 放电过程中,负极质量会增加
B. Ag2O 电极发生还原反应
C. Zn 电极的电极反应式:Zn-2eˉ+2OHˉ=Zn(OH)2
D. 放电前后电解质溶液的碱性保持不变
【答案】D
【解析】原电池反应Zn+Ag2O+H2O=Zn(OH)2+2Ag中,负极反应为Zn+2OH--2e-=Zn(OH)2、正极反应为Ag2O+H2O+2e-=2Ag+2OH-,电子由负极流向正极,以此来解答。
A、活泼金属Zn为负极,负极反应为Zn+2OH--2e-=Zn(OH)2,A正确;
B、Ag2O电极为正极,发生还原反应,正极反应为Ag2O+H2O+2e-=2Ag+2OH-,发生还原反应,B正确;
C、活泼金属Zn为负极,负极反应为Zn+2OH--2e-=Zn(OH)2,C正确;
D、氢氧根离子物质的量虽然不变,但水的量减少,KOH的浓度增大,pH增大,D错误;
答案选D。

练习册系列答案
相关题目