题目内容
【题目】取16.8 g碳酸氢钠固体加热一段时间后,剩余固体质量13.7 g,把剩余固体加入到100 mL2 mol/L的稀硫酸中,充分反应后溶液中氢离子的浓度约为
A.1.4 mol/LB.3 mol/LC.0.5 mol/LD.2 mol/L
【答案】D
【解析】
发生2NaHCO3![]() Na2CO3+CO2↑+H2O,加热一段时间后,剩余固体质量13.7g,利用差量法确定固体的成分,加盐酸发生HCO3-+H+=H2O+CO2↑、CO32-+2H+=H2O+CO2↑,以此计算反应后溶液中氢离子的浓度。
Na2CO3+CO2↑+H2O,加热一段时间后,剩余固体质量13.7g,利用差量法确定固体的成分,加盐酸发生HCO3-+H+=H2O+CO2↑、CO32-+2H+=H2O+CO2↑,以此计算反应后溶液中氢离子的浓度。
16.8g碳酸氢钠的物质的量n(NaHCO3)=![]() =0.2 mol,将该固体加热,发生反应:2NaHCO3
=0.2 mol,将该固体加热,发生反应:2NaHCO3![]() Na2CO3+CO2↑+H2O,根据方程式可知:每有168 gNaHCO3发生分解反应,固体质量会减少(44+18) g=62 g,加热一段时间后,剩余固体的质量为13.7 g,分解的NaHCO3质量为16.8 g-13.7 g=3.1g,所以反应的NaHCO3的物质的量n(NaHCO3)=
Na2CO3+CO2↑+H2O,根据方程式可知:每有168 gNaHCO3发生分解反应,固体质量会减少(44+18) g=62 g,加热一段时间后,剩余固体的质量为13.7 g,分解的NaHCO3质量为16.8 g-13.7 g=3.1g,所以反应的NaHCO3的物质的量n(NaHCO3)=![]() =0.1mol,反应产生的Na2CO3的物质的量为0.05 mol,因此反应后剩余固体中含Na2CO30.05 mol,含有NaHCO30.1 mol,100 mL 2 mol/L的稀硫酸中n(H+)=0.1 L×2 mol/L×2=0.4 mol,由CO32-+2H+=H2O+CO2↑可知0.05 mol Na2CO3反应消耗0.1 mol H+,由HCO3-+H+=H2O+CO2↑可知0.1 mol NaHCO3反应消耗0.1 mol H+,所以溶液中剩余H+物质的量为0.4 mol-0.1 mol-0.1 mol=0.2 mol,故充分反应后溶液中氢离子的浓度约为c(H+)=
=0.1mol,反应产生的Na2CO3的物质的量为0.05 mol,因此反应后剩余固体中含Na2CO30.05 mol,含有NaHCO30.1 mol,100 mL 2 mol/L的稀硫酸中n(H+)=0.1 L×2 mol/L×2=0.4 mol,由CO32-+2H+=H2O+CO2↑可知0.05 mol Na2CO3反应消耗0.1 mol H+,由HCO3-+H+=H2O+CO2↑可知0.1 mol NaHCO3反应消耗0.1 mol H+,所以溶液中剩余H+物质的量为0.4 mol-0.1 mol-0.1 mol=0.2 mol,故充分反应后溶液中氢离子的浓度约为c(H+)=![]() =2 mol/L,故合理选项是D。
=2 mol/L,故合理选项是D。

 阅读快车系列答案
阅读快车系列答案【题目】实验室常用亚硫酸钠固体和70%的浓硫酸制备SO2气体,反应方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,请设计一套实验装置,收集一试管干燥的SO2气体。
(1)在下面方框中,A表示由分液漏斗和锥形瓶组成的气体发生器,请在答题卡上的A后完成该反应的实验装置示意图(夹持装置、连接胶管不必画出,尾气处理部分必须画出,需要加热的仪器下方用△标出),按气流方向在每件仪器下方标出字母B、C…;其它可选用的仪器(数量不限)简易表示如下:___

(2)根据方框中的装置图甲,在答题卡上填写下表(可不填满)___
仪器标号 | 仪器中所加物质 | 作用 |
A | 亚硫酸钠、浓硫酸 | 产生SO2 |
(3)某实验小组用如图乙装置测定收集到的气体中SO2的含量,反应管中装有酸性高猛酸钾溶液。
①SO2和酸性高猛酸钾溶液发生反应的离子方程式为:___。
②反应管内溶液紫红色消失后,若没有及时停止通气,则测得的SO2含量___(选填:“偏高”、“偏低”或“无影响”)
③若酸性高猛酸钾溶液体积为V1mL,浓度为cmol/L,量气管内增加的水的体积为V2mL(已折算成标准状况下的体积)。用c、V1、V2表示SO2的体积百分含量为___。
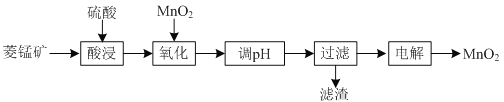
【题目】以菱锰矿![]() 主要成分
主要成分![]() ,还含有
,还含有![]() 、
、![]() 等杂质
等杂质![]() 为原料制备二氧化锰的工艺流程如下:
为原料制备二氧化锰的工艺流程如下:
已知部分金属离子开始沉淀及沉淀完全时的pH如下表所示:
金属离子 |
|
|
|
|
开始沉淀时的pH |
|
|
|
|
沉淀完全时的pH |
|
|
|
|
(1)①“酸浸”时![]() 发生反应的离子方程式为________________________________________。
发生反应的离子方程式为________________________________________。
②“酸浸”过程中加入过量硫酸的目的除了加快酸浸的速率、_____________、___________。
③要提高“酸浸”的速率,还可以采取的方法是________________________________________。
(2)“氧化”时发生反应的离子方程式为________________________________________。
(3)“调pH”的目的是除去溶液中的杂质金属离子,“调pH”的范围应为_______________。
(4)当溶液中c(Al3+)≤10-5mol/L时,则认为![]() 沉淀完全,则
沉淀完全,则![]() ______________。
______________。