题目内容
【题目】A是一种重要的化工原料,标况下密度1.25 g/L;C是一种酸性物质,D是具有果香气味的烃的衍生物。A、B、C、D在一定条件下存在如下转化关系(石蜡油含17个碳原子以上的液态烷烃,部分反应条件、产物被省略)。
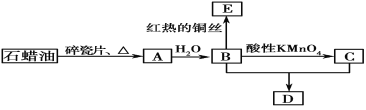
写出下列变化的化学方程式并指出反应类型:
①A→B:_____________________;
②B+C→D: __ ;
【答案】CH2=CH2+H2O![]() CH3CH2OH;加成反应
CH3CH2OH;加成反应
CH3CH2OH+CH3COOH![]() CH3COOC2H5+H2O;酯化反应
CH3COOC2H5+H2O;酯化反应
【解析】
试题分析:A是一种重要的化工原料,标况下密度1.25 g/L,则A的相对分子质量=1.25×22.4=28,所以A是乙烯,乙烯和水发生加成反应生成乙醇,即B是乙醇,乙醇发生催化氧化生成E,则E是乙醛;C是一种酸性物质,这说明因此被酸性高锰酸钾溶液为乙酸,D是具有果香气味的烃的衍生物,这说明乙醇和乙酸发生酯化反应生成乙酸乙酯,则D是乙酸乙酯。
①根据以上分析可知A→B发生加成反应,反应的方程式为CH2=CH2+H2O![]() CH3CH2OH;
CH3CH2OH;
②根据以上分析可知A→B发生酯化反应,方程式为CH3CH2OH+CH3COOH![]() CH3COOC2H5+H2O。
CH3COOC2H5+H2O。

【题目】元素推断题:
X、Y、Z、W为四种短周期元素,其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如下图所示:
X | Y | |
Z | W |
请回答下列问题:
(1)W位于周期表中第 周期,第 族。
(2)X可形成双原子分子,其分子的电子式是 ;Y和氢元素形成的10电子微粒中常见的+1价阳离子为 (填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子为 。
(3)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式 。
(4)在一定条件下,由元素Y和Z组成的一种气态化合物可发生催化氧化反应,反应达平衡进有三种气态物质共存,已知每转移4mol电子放热190.0kJ,该反应的热化学方程式为 。
【题目】亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,使用过量会使人中毒,国际上对食品中亚硝酸钠的用量控制在很低的水平上。某学习小组针对亚硝酸钠设计了如下实验:
【实验I】制备NaNO2
该小组查阅资料知:2NO+Na2O2=2NaNO2; 2NO2+Na2O2=2NaNO3
设计制备装置如下(夹持装置略去):
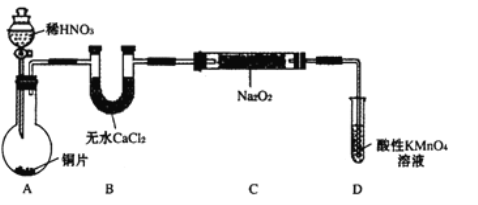
(1)装置D可将剩余的NO氧化成NO3-,发生反应的离子方程式为 。
(2)如果没有B装置,C中发生的副反应有 , 。
(3)甲同学检查完装置气密性良好后进行实验,发现制得的NaNO2中混有较多的NaNO3杂质。于是在A与B装置间增加了 装置,改进后提高了NaNO2的纯度。
【实验Ⅱ】测定制取的样品中NaNO2的含量
步骤:
a.在5个有编号的带刻度试管(比色管)中分别加入不同量的NaNO2溶液,各加入1 mL的M溶液(M遇NaNO2呈紫红色,NaNO2浓度越大颜色越深),再加蒸馏水至总体积均为10 mL并振荡,制成标准色阶:
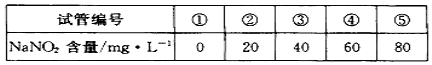
b.称量0.10 g制得的样品溶于水配成500 mL溶液。取5 mL待测液,加入1 mL M溶液,后加蒸馏水至10 mL振荡,与标准色阶比较。
(4)步骤b中比较结果是:待测液颜色与③号色阶相同。则甲同学制得的样品中NaNO2的质量分数是 %。
(5)用目视比色法证明维生素C可以有效降低NaNO2的含量。设计并完成下列实验报告。
实验方案 | 实验现象 | 实验结论 |
取5mL待测液加入 ,振荡,再加入1ml M溶液 , ,再振荡,与③号色阶对比。 | 维生素C可以有效降低NaNO2 的含量。 |
