��Ŀ����
��ס��������º��ݵ��ܱ������У��ֱ����һ������A��B��������Ӧ��A(g)��B(g)  xC(g) ��H��0�������������c(A)��ʱ��t�ı仯��ͼ��ʾ��
xC(g) ��H��0�������������c(A)��ʱ��t�ı仯��ͼ��ʾ��

����˵����ȷ����
A��x=1
B��Q1��2Q2
C������������Ϣ������aֵ
D�����������������䣬��ʼʱ������������0.2 mol A��0.2 mol B��0.2 mol C�����ʱv(��)�� v(��)
 xC(g) ��H��0�������������c(A)��ʱ��t�ı仯��ͼ��ʾ��
xC(g) ��H��0�������������c(A)��ʱ��t�ı仯��ͼ��ʾ��
| ���� | �� | �� |
| �ݻ���L�� | 0.5 | 0.5 |
| ��Ӧ���ȣ�kJ�� | Q1 | Q2 |
| ��Ӧ����ʼ�� | 1 molA 1 molB | 0.5 molA 0.5 molB |
����˵����ȷ����
A��x=1
B��Q1��2Q2
C������������Ϣ������aֵ
D�����������������䣬��ʼʱ������������0.2 mol A��0.2 mol B��0.2 mol C�����ʱv(��)�� v(��)
AB
�������������ͼ�����ݿ�֪�������Ϊ0.5L����Ͷ����A��1molʱ��0.5molʱ���ﵽƽ���ǰ�߲��Ǻ��ߵ���������ƽ��ʱ����AŨ��С��1mol/L������˵��x������2�������������С������x=1��������Ҳ���ǵ�Чƽ�⡣�ɼ���A��ת��������һ�뼴ת��������0.5mol������A��ת��������50%����ת����0.25mol,��֪�ų�������Q1��2Q2 ��B��ȷ������������Ӧ����ͬ�����£�ƽ�ⳣ����ͬ��ͨ����̬���ɼ����a��ֵ����������t2ʱ��ƽ������ϵ�����ƽ�ⳣ��K=2,����D������Q=0.4/0.4*0.4=2.5��2��˵����Ӧ�������ƶ���v(��)< v(��)������

��ϰ��ϵ�д�
 �����Ծ���ĩ���100��ϵ�д�
�����Ծ���ĩ���100��ϵ�д� ˫��ͬ������ѵ��ϵ�д�
˫��ͬ������ѵ��ϵ�д� �Ƹ�С״Ԫͬ������������ϵ�д�
�Ƹ�С״Ԫͬ������������ϵ�д�
�����Ŀ
 cC(g) + dD(g)����Ӧ�����У���������������ʱ��C�İٷֺ�����C%�����¶ȣ�T����ѹǿ��P���Ĺ�ϵ��ͼ����������ȷ����
cC(g) + dD(g)����Ӧ�����У���������������ʱ��C�İٷֺ�����C%�����¶ȣ�T����ѹǿ��P���Ĺ�ϵ��ͼ����������ȷ����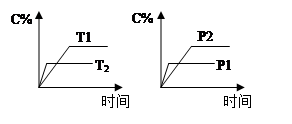
 2Z(g)��ƽ�ⳣ��Ϊ1 600�����¶��£����ݻ�һ�����ܱ������м���һ������X��Y����Ӧ��ijʱ�̲�ø���ֵ�Ũ�����£�
2Z(g)��ƽ�ⳣ��Ϊ1 600�����¶��£����ݻ�һ�����ܱ������м���һ������X��Y����Ӧ��ijʱ�̲�ø���ֵ�Ũ�����£�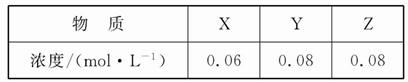
 2H2(g)+S2(g)
2H2(g)+S2(g) 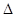 H��0�����ı���������������º�����˵����
H��0�����ı���������������º�����˵����




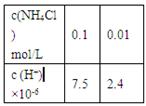
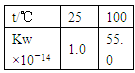
 A2(g) ��B2(g),����ȷ���ﵽƽ��״̬����
A2(g) ��B2(g),����ȷ���ﵽƽ��״̬���� Cl2(g)��CO(g)����2.0 L�����ܱ������г���
Cl2(g)��CO(g)����2.0 L�����ܱ������г��� nY(g) ��H��Q kJ��mol-1����Ӧ�ﵽƽ��ʱ��X�����ʵ���Ũ�����¶ȡ���������Ĺ�ϵ���±���ʾ��
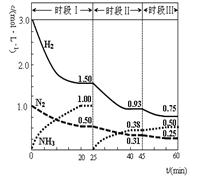
nY(g) ��H��Q kJ��mol-1����Ӧ�ﵽƽ��ʱ��X�����ʵ���Ũ�����¶ȡ���������Ĺ�ϵ���±���ʾ�� 2NH3(g) ��H����92.4 kJ��mol-1������ʱ�� ��ϵ�и�����Ũ����ʱ��仯��������ͼʾ������˵������ȷ���ǣ� ��
2NH3(g) ��H����92.4 kJ��mol-1������ʱ�� ��ϵ�и�����Ũ����ʱ��仯��������ͼʾ������˵������ȷ���ǣ� ��