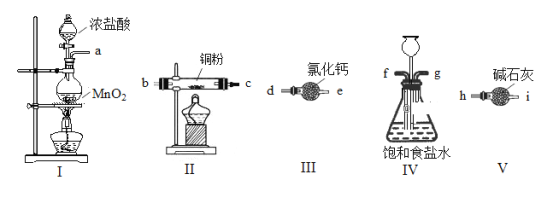
题目内容
【题目】由下列实验现象一定能得出相应结论的是
选项 | A | B | C | D |
装置图 |
|
|
|
|
现象 | 右边试管产生气泡较快 | 左边棉球变棕黄色,右边棉球变蓝色 | 试管中先出现淡黄色固体,后出现黄色固体 | 试管中液体变浑浊 |
结论 | 催化活性:Fe3+>Cu2+ | 氧化性:Br2>I2 | Ksp:AgCl>AgBr>AgI | 非金属性:C>Si |
A. AB. BC. CD. D
【答案】A
【解析】
A.两溶液c(Cl-)相同,可排除氯离子的影响,c(Fe3+)比c(Cu2+)小,也排除了浓度的影响,而右边产生的气泡快,说明催化活性:Fe3+![]() Cu2+,故A正确;
Cu2+,故A正确;
B.生成的溴蒸汽中混有氯气,氯气和溴蒸汽均能氧化KI生成碘,所以不能说明氧化性Br2![]() I2,故B错误;
I2,故B错误;
C.2ml的AgCl悬浊液,滴加2-3滴NaBr后,有淡黄色沉淀,此时溶液中还含有大量的AgCl,再滴2-3滴NaI溶液,有黄色沉淀,可能是AgCl转化成了AgI,则不能证明Ksp:AgBr ![]() AgI,故C错误;
AgI,故C错误;
D.生成的CO2会混有HCI,所以不能说明碳酸的酸性不硅酸的酸性强,则不能证明非金属性C![]() Si,故D错误;
Si,故D错误;
本题答案为A。

 阅读快车系列答案
阅读快车系列答案【题目】铬铁矿(FeCr2O4)中含有Al2O3、Fe2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的工艺流程示意图如下(部分操作和条件略):
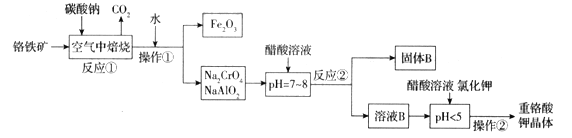
(1)铬铁矿(FeCr2O4)改写为氧化物的形式为___________________。
(2)反应①中发生了两个主要反应,其中一个主要反应的化学方程式为4FeCr2O4+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2;另一个主要反应的化学方程式为 ______________________________。
8Na2CrO4+2Fe2O3+8CO2;另一个主要反应的化学方程式为 ______________________________。
(3)写出反应②中生成固体B的离子方程式为_________________________________。
(4)pH < 5时,发生反应有____________________________________(写离子方程式),Na2Cr2O7 + 2KCl = K2Cr2O7↓+ 2NaCl。
下表是相关物质的溶解度数据:
物质 | 溶解度 ( g / 100 g H2O ) | ||
0℃ | 40℃ | 80℃ | |
KCl | 28 | 40.1 | 51.3 |
NaCl | 35.7 | 36.4 | 38 |
K2Cr2O7 | 4.7 | 26.3 | 73 |
Na2Cr2O7 | 163 | 215 | 376 |
获得K2Cr2O7晶体的操作由多步组成,依次是加入KCl固体、蒸发浓缩、________________、_____________、洗涤、干燥得到晶体。
(5)某种酒精测试仪中,K2Cr2O7在酸性条件下将乙醇氧化为乙酸,自身被还原为三价铬离子,该反应的氧化剂与还原剂的物质的量比为_________________。
(6)含铬废渣(废水)的随意排放对环境有极大危害,电解法是处理铬污染的一种方法,电解时,在阴极区有Fe(OH)3和Cr(OH)3沉淀生成(已知Ksp[Fe(OH)3] = 4.0×10-38,KspCr(OH)3] = 6.0×10-31)。已知电解后的溶液中c(Cr3+)为3.0×10-5mol/L,则溶液中c(Fe3+)为________________ mol/L。
【题目】下表为元素周期表的一部分用元素符号或化学式回答下列问题。
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑥ | ① | ⑦ | ④ | ||||
3 | ③ | ⑤ | ⑧ | ⑩ | ||||
4 | ② | ⑨ |
(1)写出⑥与⑧元素组成的分子的电子式:________。
(2)①的气态氢化物与其最高价氧化物水化物反应的方程式为_______________,第三周期中除⑩元素以外离子半径最小的是_________(填离子符号)。
(4)元素⑧的单质与②⑨形成的化合物的溶液反应的离子方程式为______________。在反应后的溶液中加入有机溶剂四氯化碳(CCl4),振荡后静置的实验现象为_______________。
(5)与②同主族,第三周期的元素单质在⑦的单质中燃烧生成的化合物的电子式________;④⑧⑨元素的离子的还原性由强到弱顺序为____________(用离子符号)。