题目内容
【题目】一定温度下,下列溶液的离子浓度关系式正确的是
A.稀释氨水溶液 10 倍后,其 c(OH-)为原来的![]()
B.pH 之和为 14 的 H2C2O4与 NaOH 溶液混合:c(Na+)+c(H+)=c(OH-)+ c(HC2O4-)
C.pH=5 的 H2S 溶液中,c(H+)=c(HS-)=1×10-5mol/L
D.将等物质的量的Na2CO3 和 NaHCO3 混合溶于水中![]() <1
<1
【答案】D
【解析】
A.一水合氨在稀释过程中继续电离生成OH-,所以稀释氨水溶液10倍后,其c(OH-)大于原来的![]() ,故A错误;
,故A错误;
B.任何电解质溶液中都存在电荷守恒,根据电荷守恒得(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-),所以c(Na+)+c(H+)>c(OH-)+c(HC2O4-),故B错误;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(H+)=c(HS-)+2c(S2-)+c(OH-),所以c(H+)>c(HS-),故C错误;
D.Na2CO3的水解程度大于NaHCO3,导致溶液中c(HCO3-)>c(CO32-),则![]() <1,故D正确;
<1,故D正确;
故选D。

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案【题目】利用含铬废料(主要含 Cr2O3,还含有 FeO、SiO2、Al2O3 等杂质)制备重铬酸钠,实现清洁化工生产,工艺流程如图:
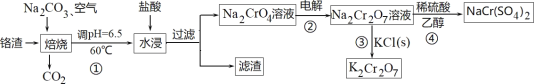
回答下列问题:
(1)焙烧 Cr2O3 转化为Na2CrO4 的化学反应方程式是_____;
(2)实验室模拟此工业流程①,控制反应温度 60℃的方法是_____;
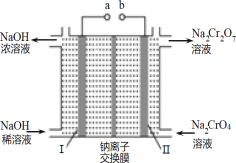
(3)流程②用石墨做电极电解 Na2CrO4 溶液,制备Na2Cr2O7,其原理如图所示,a 是_____极;电极Ⅱ的电极反应式是_____;当生成 2mol Na2Cr2O7时,电路中转移的电子_____mol;
(4)由下图和下表中的溶解度变化,流程③制备 K2Cr2O7,应先充分加热,然后_____反应才能顺利进行;

重铬酸钠的溶解度表:
温度℃ | 10 | 20 | 40 | 60 | 80 | 100 |
溶解度% | 61.6 | 62.8 | 65.1 | 71.8 | 78.7 | 81.1 |
(5)为进一步减少制得的 K2Cr2O7 晶体中 NaCl 等杂质,应再进行_____操作;
(6)流程④Na2Cr2O7 溶液与乙醇反应,乙醇可能被氧化为_____(写一种即可)。