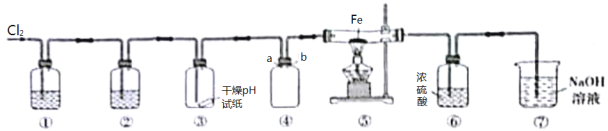
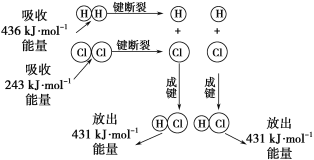
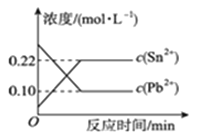
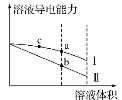
��Ŀ����
����Ŀ��������������Ҫ������������������ƽ�⣺ 2NO2(g)![]() N2O4(g)��
N2O4(g)��
��1����֪��2NO2(g)![]() N2O4(g) ��H=��57.20kJ��mol��1��һ�������£������һ�����ܱ������з�Ӧ2NO2(g)
N2O4(g) ��H=��57.20kJ��mol��1��һ�������£������һ�����ܱ������з�Ӧ2NO2(g)![]() N2O4(g)�ﵽƽ�⣮������������ʱ�����д�ʩ�����NO2ת���ʵ���_________������ĸ����
N2O4(g)�ﵽƽ�⣮������������ʱ�����д�ʩ�����NO2ת���ʵ���_________������ĸ����
A����СNO2��Ũ�� B�������¶� C������NO2��Ũ�� D�������¶�
��2��17�桢1.01��105Pa���ܱ�������N2O4��NO2�Ļ������ﵽƽ��ʱ��c(NO2)=0.0300mol��L��1��c(N2O4)=0.0120mol��L��1,��Ӧ2NO2(g)![]() N2O4(g)��ƽ�ⳣ��K=__________��
N2O4(g)��ƽ�ⳣ��K=__________��
���𰸡�BC 13.3
��������
��1���÷�Ӧ�Ƿ�Ӧǰ�����������С�ġ����ȵĿ��淴Ӧ��Ҫ��߶���������ת���ʣ�ֻҪ�ı�����ʹ��ѧƽ��������Ӧ�����ƶ����ɣ�
��2������ƽ�ⳣ������ʽK= �����㣻
�����㣻
��1���÷�Ӧ�Ƿ�Ӧǰ�����������С�ġ����ȵĿ��淴Ӧ��Ҫʹ�÷�Ӧ������Ӧ�����ƶ����ɸı䷴Ӧ���Ũ�ȡ���ϵ��ѹǿ���¶ȵȡ�
A. ��СNO2��Ũ�ȣ��൱�ڼ�Сѹǿ����ƽ�����淴Ӧ�����ƶ���NO2��ת���ʽ��ͣ�A�����
B. �÷�Ӧ�Ƿ��ȷ�Ӧ�����¶ȣ�ƽ��������Ӧ�����ƶ���NO2��ת������ߣ�B����ȷ��
C. ����NO2��Ũ�ȣ�ƽ��������Ӧ�����ƶ�������ϵѹǿ����Ҳ���ڷ�Ӧ������Ӧ�����ƶ���C����ȷ��
D. �÷�Ӧ�Ƿ��ȷ�Ӧ���������¶ȣ�ƽ�����淴Ӧ�����ƶ���NO2��ת���ʽ��ͣ�D�����
�ʴ�Ϊ��BC��
��3��ƽ��ʱ�� c(NO2)=0.0300mol��L��1��c(N2O4)=0.0120mol��L��1����Ӧ2NO2(g)N2O4(g)��ƽ�ⳣ��K=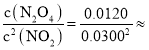 13.3���ʴ�Ϊ��13.3��
13.3���ʴ�Ϊ��13.3��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ����֪ij��ѧ��Ӧ��ƽ�ⳣ������ʽΪK=![]() ���ڲ�ͬ���¶��¸÷�Ӧ��ƽ�ⳣ�������ʾ��
���ڲ�ͬ���¶��¸÷�Ӧ��ƽ�ⳣ�������ʾ��
t/�� | 700 | 800 | 830 | 1 000 | 1 200 |
K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
�����й���������ȷ���ǣ�������
A. �÷�Ӧ�Ļ�ѧ����ʽ��CO��g��+H2O��g��![]() CO2��g��+H2��g��
CO2��g��+H2��g��
B. ������Ӧ������Ӧ�Ƿ��ȷ�Ӧ
C. ����1L���ܱ�������ͨ��CO2��H2��1mol��5min���¶����ߵ�830�棬��ʱ���CO2Ϊ0.4molʱ���÷�Ӧ�ﵽƽ��״̬
D. ��ƽ��Ũ�ȷ������й�ϵʽ��![]() �����ʱ���¶�Ϊ1000��
�����ʱ���¶�Ϊ1000��