题目内容
【题目】铂钴合金是以铂为基含钴二元合金,在高温下,铂与钴可无限互溶,其固溶体为面心立方晶格。铂钴合金磁性极强,磁稳定性较高,耐化学腐蚀性很好,主要用于航天航空仪表、电子钟表、磁控管等。
(1)基态钴原子的价电子排布图为___________。
(2)二氯二吡啶合铂是由Pt2+、Cl-和吡啶结合形成的铂配合物,有顺式和反式两种同分异构体(如下图)。科学研究表明,顺式分子具有抗癌活性。

①吡啶分子是大体积平面配体,其结构简式如图所示![]() 。每个吡啶分子中含有的σ键数目为___________。吡啶分子中所含的各元素的电负性由大到小的顺序是___________。
。每个吡啶分子中含有的σ键数目为___________。吡啶分子中所含的各元素的电负性由大到小的顺序是___________。
②二氯二吡啶合铂中存在的微粒间作用力有___________(填字母)。
a.范德华力 b.氢键 c.金属键 d.非极性键
③反式二氯二吡啶合铂分子是___________(填“极性分子”或“非极性分子”)。

(3)某研究小组将平面型的铂配合物分子进行层状堆砌,使每个分子中的铂原子在某一方向上排列成行,构成能导电的“分子金属”,其结构如下图所示。
①“分子金属”可以导电,是因为___________能沿着其中的金属原子链流动。
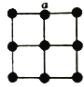
②“分子金属”中,铂原子是否以sp3的方式杂化?_________(填“是”或“否”),其理由是_______。
(4)金属铂晶体中,铂原子的配位数为12,其立方晶胞沿x、y或z轴的投影图如图所示。若金属铂的密度为dg·cm-3,则晶胞参数a=______nm(列计算式)。
【答案】![]() 11 N>Cl>C ad 非极性分子 电子 否 若铂原子轨道为sp3杂化,则该分子结构为四面体,非平面结构
11 N>Cl>C ad 非极性分子 电子 否 若铂原子轨道为sp3杂化,则该分子结构为四面体,非平面结构 ![]() (或
(或![]() )
)
【解析】
(1)钴为27号元素,价电子排布为3d74s2,则基态钴原子的价电子排布图为![]() ;
;
(2)①吡啶环上的原子形成6个![]() 键,还有5个C-H
键,还有5个C-H![]() 键,故每个吡啶分子中含有的
键,故每个吡啶分子中含有的![]() 键数目为11;
键数目为11;
同一周期主族元素从左到右第一电离能有增大的趋势,但由于氮原子核外p轨道处于半充满状态,第一电离能相对较高,故C、N、Cl三种元素的第一电离能由大到小的顺序是N>Cl>C;
②二氯二吡啶合铂为分子晶体,故含有范德华力;二氯二吡啶合铂是由Pt2+、Cl-和吡啶结合形成的铂配合物,Pt2+、与2个Cl-、吡啶形成配位键,没有离子键,吡啶中碳原子之间形成极性键、不同原子之间形成非极性键,C-H键中氢原子不能形成氢键,也没有金属键,故选ad项。
③反式二氯二吡啶合铂分子结构式为: 其结构对称,是非极性分子。
其结构对称,是非极性分子。
(3)①金属中不含阴阳离子,其能导电是因为电子定向移动形成电流;
②该分子为平面型的铂配合物分子,铂原子轨道不能sp3杂化。
(4)金属铂晶体中,铂原子的配位数为12,为立方晶胞,结合沿x、y或z轴的投影图,可知铂为面心立方最密堆积,Pt原子处于顶点、面心,晶胞中Pt原子数目=8![]() +6
+6![]() =4,则
=4,则![]() =d g·cm-3
=d g·cm-3![]() ,解得a=
,解得a=![]() (或
(或![]() )。
)。
(1)钴为27号元素,价电子排布为3d74s2,则基态钴原子的价电子排布图为![]() ;
;
故答案为:![]() ;
;
(2)①吡啶环上的原子形成6个![]() 键,还有5个C-H
键,还有5个C-H![]() 键,故每个吡啶分子中含有的
键,故每个吡啶分子中含有的![]() 键数目为11;
键数目为11;
同一周期主族元素从左到右第一电离能有增大的趋势,但由于氮原子核外p轨道处于半充满状态,第一电离能相对较高,故C、N、Cl三种元素的第一电离能由大到小的顺序是N>Cl>C;
②二氯二吡啶合铂为分子晶体,故含有范德华力;二氯二吡啶合铂是由Pt2+、Cl-和吡啶结合形成的铂配合物,Pt2+、与2个Cl-、吡啶形成配位键没有离子键,吡啶中碳原子之间形成极性键、不同原子之间形成非极性键,C-H键中氢原子不能形成氢键,也没有金属键,故选ad项。
③反式二氯二吡啶合铂分子结构式为: 其结构对称,是非极性分子。
其结构对称,是非极性分子。
故答案为:11;N>Cl>C;ad;非极性分子;
(3)①分子金属中不含自由移动的阴、阳离子,其能导电是因为有自由电子能沿着其中的金属原子链流动,电子定向移动形成电流;
②该分子为平面型的铂配合物分子,铂原子轨道不能sp3杂化,若铂原子轨道为sp3杂化,则该分子结构为四面体,非平面结构;
故答案为:电子;否;若铂原子轨道为sp3杂化,则该分子结构为四面体,非平面结构;
(4)金属铂晶体中,铂原子的配位数为12,为立方晶胞,结合沿x、y或z轴的投影图,可知铂为面心立方最密堆积,Pt原子处于顶点、面心,晶胞中Pt原子数目=8![]() +6
+6![]() =4,则晶胞的质量为
=4,则晶胞的质量为![]() =d g·cm-3
=d g·cm-3![]() ,解得a=
,解得a=![]() (或
(或![]() )。
)。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案