��Ŀ����
����Ŀ������Ҫ���������ʵ�顣(a��bΪ���ͼУ�����װ����ȥ)

I��֤SO2���������ԡ���ԭ�Ժ������������ͨ�ԡ�
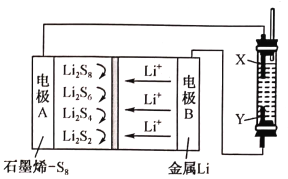
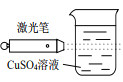
(1) �������������װ�������ԡ���ҩƷ��b (�ر�a)��Ȼ�����Ũ���ᣬ���ȡ�װ��Ũ���������������___________��ͭ��Ũ���ᷴӦ�Ļ�ѧ����ʽ��___________ ��
(2) ����֤SO2���������Ե�ʵ��������__________________________________________��
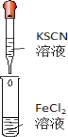
(3) װ��BaCl2��Һ���Թ������κ�������ֳ����ݣ��ֱ�μӰ�ˮ����ˮ����������ɫ�����������Ļ�ѧʽ�ֱ���___________��___________��д������SO2��ʾ��ԭ�Բ����ɰ�ɫ�������ܵ����ӷ���ʽ____________________________________________��
(4) ����֤SO2���������������ͨ�Ե�ʵ��������________________________________�� ��ͨ�������SO2���仯ѧ����ʽ��____________________________________________��
II��֤���Ե����ǿ����̼��>�����ᡣ(��֪���ԣ�������>̼��)
(5) ��a�ر�b��װ��A�е��������Լ���___________�����ø�װ���ܷ��ж�̼������Աȴ�����ǿ��������_______________________________________________________��
���𰸡���Һ©�� Cu+2H2SO4��Ũ��![]() CuSO4+ SO2��+2H2O װ��H2S��Һ���Թܱ���� BaSO3 BaSO4 Ba2++SO2+Cl2+2 H2O=BaSO4��+4H++2Cl- װ���������ƣ���̪����Һ���Թ�����Һ��ɫ SO2+NaOH=NaHSO3 ���Ը��������Һ �ܣ�ʢ�д��������Һ���Թܱ����
CuSO4+ SO2��+2H2O װ��H2S��Һ���Թܱ���� BaSO3 BaSO4 Ba2++SO2+Cl2+2 H2O=BaSO4��+4H++2Cl- װ���������ƣ���̪����Һ���Թ�����Һ��ɫ SO2+NaOH=NaHSO3 ���Ը��������Һ �ܣ�ʢ�д��������Һ���Թܱ����
��������
��1����Һ©����װ��Ũ���ᣬŨ������ͭ���ȷ�Ӧ��������ͭ�����������ˮ��
��2����������������H2S��Һ�����·�Ӧ�����ɻ�ɫ�������ʣ���ˮ֤������������������ԣ�
��3����������Ϊ����������백ˮ��Ӧ����������泥�����������Ȼ�����Ӧ�������ᱵ������ˮ���������ᣬ�������Ȼ�����Ӧ�������ᱵ��
��4��������������������������Һ��Ӧ�������������ƣ�
��5����a�ر�b����ʵ�����ڱȽ������ᡢ̼��ʹ�������������ǿ����
��1����ʵ��װ��ͼ��֪����Һ©����װ��Ũ���ᣬŨ������ͭ���ȷ�Ӧ��������ͭ�����������ˮ����Ӧ�Ļ�ѧ����ʽΪCu+2H2SO4��Ũ��![]() CuSO4+ SO2��+2H2O���ʴ�Ϊ����Һ©����Cu+2H2SO4��Ũ��
CuSO4+ SO2��+2H2O���ʴ�Ϊ����Һ©����Cu+2H2SO4��Ũ��![]() CuSO4+ SO2��+2H2O��
CuSO4+ SO2��+2H2O��
��2��������������Ԫ�صĻ��ϼ���+4�ۣ����������ԣ���������������H2S��Һ�����·�Ӧ�����ɻ�ɫ�������ʣ���ˮ����Ӧ�ķ���ʽΪ��2H2S+SO2�T3S��+2H2O���ʴ�Ϊ��װ��H2S��Һ���Թܱ���ǣ�
��3����������Ϊ����������백ˮ��Ӧ����������泥�����������Ȼ�����Ӧ���������ᱵ������SO2���л�ԭ�ԣ�����ˮ��Ӧ������������ᣬ�������Ȼ�����Ӧ�������ᱵ��������Ӧ�����ӷ���ʽΪBa2++SO2+Cl2+2 H2O=BaSO4��+4H++2Cl-���ʴ�Ϊ��BaSO3��BaSO4��Ba2++SO2+Cl2+2 H2O=BaSO4��+4H++2Cl-��
��4����������Ϊ���������������������������������Һ��Ӧ�������������ƣ���Һ��ɫ��ȥ����Ӧ�Ļ�ѧ����ʽΪSO2+NaOH=NaHSO3���ʴ�Ϊ��װ���������ƣ���̪����Һ���Թ�����Һ��ɫ��SO2+NaOH=NaHSO3��
(5) ��a�ر�b����ʵ�����ڱȽ������ᡢ̼��ʹ�������������ǿ������������������ǿ��̼�ᣬ��Ӧ���ɵĶ���������̼��������Һ��Ӧ���ɶ�����̼���壬��Ӧ���ɵĻ������ͨ��ʢ�����������Ը��������Һ���Թܳ�ȥ�����������壬������̼��������������Һ��Ӧ����̼��ư�ɫ��������Һ����ǣ�˵��̼�������ǿ�ڴ����ᣬ�ʴ�Ϊ�����Ը��������Һ���ܣ�ʢ�д��������Һ���Թܱ���ǡ�

 �����������һ��һ��ϵ�д�
�����������һ��һ��ϵ�д� Ӧ������ҵ��ϵ�д�
Ӧ������ҵ��ϵ�д�����Ŀ���Ƶij������ϼ�Ϊ��3�ۣ��ҹ��̲��ŷḻ�ĺ��ƿ�ʯ(Y2FeBe2Si2O10)����ҵ��ͨ�������������̿ɻ�������ơ�
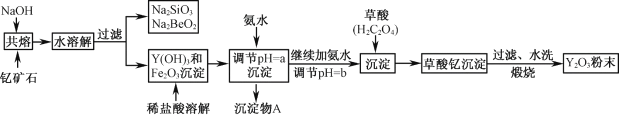
��֪���ٸ��������йؽ��������γ������������ʱ��pH���±���
���� | ��ʼ����ʱ��pH | ��ȫ����ʱ��pH |
Fe3�� | 2.1 | 3.1 |
Y3�� | 6.0 | 8.2 |
����Ԫ�����ڱ��У���Ԫ�غ���Ԫ�ش��ڵڶ����ں͵������ڵĶԽ���λ�ã���ѧ�������ơ�
(1)д��Na2SiO3��һ����;________________________��
(2)����Na2SiO3��Na2BeO2�����Һ���Ƶ�Be(OH)2������
�� ���ѡ�������_______�����Լ�����ͨ����Ҫ�IJ�������ʵ�֡�
A��NaOH��Һ B����ˮ C��CO2 D��HNO3
�� д��Na2BeO2���������ᷢ����Ӧ�����ӷ���ʽ___________________________��
(3)�����£���ӦFe3����3H2O(g) ![]() Fe (OH)3����3H+��ƽ�ⳣ��K= ______��ΪʹFe3��������ȫ���ð�ˮ����pH��aʱ��aӦ������_________��Χ�ڣ������Ӱ�ˮ����pH =b������Ӧ�����ӷ���ʽΪ____________________________��
Fe (OH)3����3H+��ƽ�ⳣ��K= ______��ΪʹFe3��������ȫ���ð�ˮ����pH��aʱ��aӦ������_________��Χ�ڣ������Ӱ�ˮ����pH =b������Ӧ�����ӷ���ʽΪ____________________________��
(4)���ղ�����ʱ�����ֽⷴӦ����������Ϊ�����ƣ����������ʹ����ʯ��ˮ����ǡ�д��������[Y2(C2O4)3��nH2O]���յĻ�ѧ����ʽ___________________________________��