题目内容
【题目】向500 mL稀硝酸中加入一定量的铁粉,铁粉完全溶解后,放出NO 6.272L(标准状况下),同时溶液质量增加11.2g。下列判断不正确的是
A.原HNO3溶液的物质的量浓度为2.24 mol·L-1
B.原溶液中投入铁粉的物质的量是0.2 mol
C.反应后溶液中c(Fe3+):c(Fe2+)=2:3
D.反应后的溶液还可以溶解铜粉4.48g
【答案】B
【解析】
6.272L(标准状况下)NO的物质的量是![]() ,质量是0.28mol×30g/mol=8.4g,溶液质量增加11.2g,说明参加反应的铁的质量是11.2+8.4=19.6g,铁的物质的量是
,质量是0.28mol×30g/mol=8.4g,溶液质量增加11.2g,说明参加反应的铁的质量是11.2+8.4=19.6g,铁的物质的量是![]() 。设反应后Fe2+的物质的量为xmol,则Fe3+的物质的量是(0.35-x)mol, 由电子转移守恒可知,2xmol+3(0.35-x)mol=0.28mol×3,解得x=0.21mol,则反应后溶液中含有Fe2+为0.21mol,Fe3+为0.14mol,据此解答。
。设反应后Fe2+的物质的量为xmol,则Fe3+的物质的量是(0.35-x)mol, 由电子转移守恒可知,2xmol+3(0.35-x)mol=0.28mol×3,解得x=0.21mol,则反应后溶液中含有Fe2+为0.21mol,Fe3+为0.14mol,据此解答。
A. 根据N元素守恒,原HNO3溶液的物质的量浓度为![]() 2.24 mol·L-1,故A正确;
2.24 mol·L-1,故A正确;
B. 参加反应的铁的质量是11.2+8.4=19.6g,铁的物质的量是![]() ,故B错误;
,故B错误;
C. Fe2+的物质的量为0.21mol, Fe3+的物质的量为0.14mol,反应后溶液中c(Fe3+):c(Fe2+)=2:3,故C正确;
D. 2Fe3++Cu=2Fe2++Cu2+,反应后的溶液含Fe3+的物质的量为0.14mol,所以还可以溶解铜粉0.07mol,质量是0.07mol ×64g/mol=4.48g,故D正确;
选B。

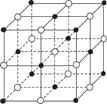
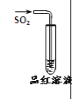
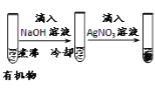
【题目】下列实验、现象及相关结论均正确的是
A | B | C | D | |
实验 |
|
|
|
|
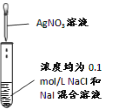
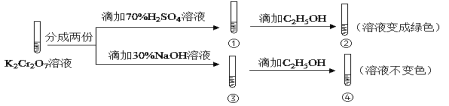
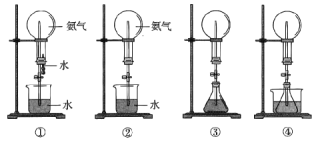
现象 | 品红褪色 | 最后试管有浅黄色沉淀 | 最后一滴溶液使酚酞由无色变为粉红色,且30s不复原 | 出现白色沉淀 |
结论 | SO2 有强强氧化性 | 有机物中含有溴原子 | 滴定达终点 | Ksp(AgCl)>Ksp(AgI) |
A.AB.BC.CD.D
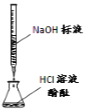
【题目】(一)某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)下列操作中可能使所测NaOH溶液的浓度数值偏低的是____________。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(2)若滴定开始和结束时,酸式滴定管中的液面如图所示,所用盐酸溶液的体积为_______mL。
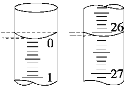
(3)某学生根据3次实验分别记录有关数据如下表:
滴定次数 | 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.50 | |
第二次 | 25.00 | 1.56 | 30.30 | |
第三次 | 25.00 | 0.22 | 26.76 | |
依据上表数据列式计算该NaOH溶液的物质的量浓度______________。
(二)已知某温度下CH3COOH的电离常数K=1.6×10-5。该温度下向20 mL 0.01 mol/L CH3COOH溶液中逐滴加入0.01 mol/L KOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:
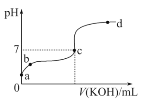
(1)c点溶液中的离子浓度大小顺序为________________。
(2)a、b、c三点中水的电离程度最大的是________。