题目内容
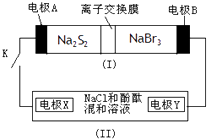
【题目】电解原理在消除环境污染领域有广泛的应用.工业上常采用如图所示电解装置,利用铁的化合物中[Fe(CN)6]3﹣可将气态废弃物中的硫化氢转化为可利用的硫,自身转化为[Fe(CN)6]4﹣ . 通电电解,然后通入H2S加以处理,下列说法不正确的是( ) 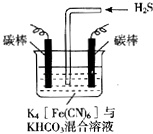
A.电解时阳极反应式为[Fe(CN)6]4﹣﹣e﹣=[Fe(CN)6]3﹣
B.电解过程中阴极区溶液的pH变大
C.整个过程中需要不断补充K4[Fe(CN)6]与KHCO3
D.通入H2S时发生反应的离子方程式为:2[Fe(CN)6]3﹣+2CO32﹣+H2S=2[Fe(CN)6]4﹣+2HCO3﹣+S↓
【答案】C
【解析】解:A、电解时阳极发生失电子的氧化反应,先将[Fe(CN)6]4﹣转化为Fe(CN)6]3﹣ , 化合价升高,所以反应为:[Fe(CN)6]4﹣﹣e﹣═[Fe(CN)6]3﹣ , 故A正确;B、电解质溶液中的阴极离子碳酸氢根离子,电离产生氢离子在阴极放电,所以电极反应式为2HCO3﹣+2 e﹣═H2↑+2CO32﹣ , pH变大,故B正确;
C、因后来发生反应为2Fe(CN)63﹣+2CO32﹣+H2S=2Fe(CN)64﹣+2HCO3﹣+S,所以整个过程中需要不断补充K4[Fe(CN)6]与KHCO3 , 故C错误;
D、通入H2S时发生反应的离子方程式为2Fe(CN)63﹣+2CO32﹣+H2S=2Fe(CN)64﹣+2HCO3﹣+S,故D正确;
故选C.

 名校课堂系列答案
名校课堂系列答案【题目】雯雯在自学碳酸钠性质时,查到了以下资料:
①CO2+Na2CO3+H2O=2NaHCO3 , CO2通入饱和碳酸钠溶液会产生白色沉淀,CO2不溶于饱和碳酸氢钠溶液。
②碳酸钠、碳酸氢钠在不同温度下的溶解度如表:
0 ℃ | 10 ℃ | 20 ℃ | 30 ℃ | |
Na2CO3 | 7.1 | 12.2 | 21.8 | 39.7 |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 |
【进行实验1】验证CO2通入饱和碳酸钠溶液会产生白色沉淀
①配制碳酸钠溶液:取100 g 20 ℃的水,加入35 g碳酸钠固体,搅拌后,静置,取上层清液。
②利用装置一进行实验,连续5分钟向新制得的碳酸钠溶液中通入CO2。
【发现问题】实验中,始终没有看到沉淀现象,原因是什么呢?雯雯进行了以下实验探究。
【进行实验2】
实验操作 | 实验现象 |
①取100 g 20 ℃的水,加入35 g碳酸钠固体,搅拌后,静置,取上层清液 | 没有出现白色沉淀 |
(1)在0 ℃~30 ℃,Na2CO3和NaHCO3的溶解度受温度变化影响较大的是。
(2)大理石与稀盐酸反应的离子方程式为。
(3)装置二中饱和碳酸氢钠溶液的作用是。
(4)【进行实验3】
实验操作 | 实验现象 |
①取100 g热开水,加入35 g碳酸钠固体,完全溶解,再降温至20 ℃,取上层清液 | 装置一和装置二中的碳酸钠溶液中均出现白色沉淀 |
雯雯在最初的实验中没有看到沉淀现象的原因是。
(5)CO2通入饱和碳酸钠溶液会产生白色沉淀的原因是。
【题目】用下列实验装置进行相应的实验,不能达到实验目的是( )
A | B | C | D | |
装置 |
|
|
|
|
实验 | 结合秒表定量比较锌与不同浓度的稀硫酸反应的快慢 | 证明温度对化学平衡的影响 | 验证铁钉发生吸氧腐蚀 | 可证明非金属性Cl>C>Si |
A.A
B.B
C.C
D.D