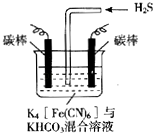
��Ŀ����
����Ŀ����������ѧ̼��������ʱ���鵽���������ϣ�
��CO2+Na2CO3+H2O=2NaHCO3 �� CO2ͨ�뱥��̼������Һ�������ɫ������CO2�����ڱ���̼��������Һ��
��̼���ơ�̼�������ڲ�ͬ�¶��µ��ܽ�������
0 �� | 10 �� | 20 �� | 30 �� | |
Na2CO3 | 7.1 | 12.2 | 21.8 | 39.7 |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 |
������ʵ��1����֤CO2ͨ�뱥��̼������Һ�������ɫ����
������̼������Һ��ȡ100 g 20 ���ˮ������35 g̼���ƹ��壬������ã�ȡ�ϲ���Һ��
������װ��һ����ʵ�飬����5���������Ƶõ�̼������Һ��ͨ��CO2��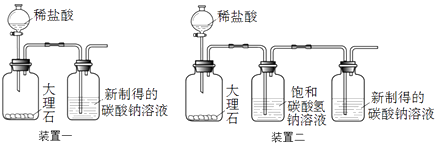
���������⡿ʵ���У�ʼ��û�п�����������ԭ����ʲô�أ���������������ʵ��̽����
������ʵ��2��
ʵ����� | ʵ������ |
��ȡ100 g 20 ���ˮ������35 g̼���ƹ��壬������ã�ȡ�ϲ���Һ | û�г��ְ�ɫ���� |
��1����0 ��~30 �棬Na2CO3��NaHCO3���ܽ�����¶ȱ仯Ӱ��ϴ������
��2������ʯ��ϡ���ᷴӦ�����ӷ���ʽΪ��
��3��װ�ö��б���̼��������Һ����������
��4��������ʵ��3��
ʵ����� | ʵ������ |
��ȡ100 g�ȿ�ˮ������35 g̼���ƹ��壬��ȫ�ܽ⣬�ٽ�����20 �棬ȡ�ϲ���Һ | װ��һ��װ�ö��е�̼������Һ�о����ְ�ɫ���� |
�����������ʵ����û�п������������ԭ������
��5��CO2ͨ�뱥��̼������Һ�������ɫ������ԭ������
���𰸡�
��1��Na2CO3
��2��CaCO3 +2H��=Ca2��+H2O+CO2��
��3���ų�HCl�ĸ���
��4�����Ƶ�̼������Һû�дﵽ����
��5��̼�������ܽ��С��̼����,ˮ����,���ɵ�̼�����Ƶ��������ڷ�Ӧ��̼����
����������1����0 ��~30 �棬Na2CO3��NaHCO3���ܽ�����¶ȱ仯Ӱ��ϴ���� Na2CO3��
��2������ʯ��ϡ���ᷴӦ�����ӷ���ʽΪ��CaCO3 +2H��=Ca2��+H2O+CO2����
��3��װ�ö��б���̼��������Һ�������������Ȼ������壬�Ӷ��ų��Ȼ��������ʵ��ĸ��ţ�
��4�������������ʵ����û�п������������ԭ�������Ƶ�̼������Һû�дﵽ���ͣ�
��5��CO2ͨ�뱥��̼������Һ�������ɫ������ԭ���ǣ�̼�������ܽ��С��̼���ƣ����ŷ�Ӧ�Ľ��У�ˮ��������С�����ɵ�̼�����Ƶ��������ڷ�Ӧ��̼���ơ�

 �����ҵ��ٿ���������������ϵ�д�
�����ҵ��ٿ���������������ϵ�д�����Ŀ��ij�о�С����ij2L�ܱ������м���һ�����Ĺ���A������B��������ӦA��s��+2B��g��D��g��+E��g����H=QkJmol��1 �� ��T1��ʱ����Ӧ���е���ͬʱ���ø����ʵ����ʵ������±���
ʱ�䣨min�� | 0 | 10 | 20 | 30 | 40 | 50 |
B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
��1��T1��ʱ���÷�Ӧ��ƽ�ⳣ��K=��
��2��30min��ֻ�ı�ijһ��������Ӧ���´ﵽƽ�⣬���ݱ��е������жϸı������������������ĸ��ţ���
a��ͨ��һ������B
b������һ�����Ĺ���A
c���ʵ���С���������
d�����߷�Ӧ��ϵ�¶�
e��ͬʱ����0.2molB��0.1molD,0.1molE
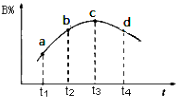
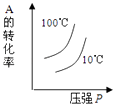
��3�����ڸ÷�Ӧ���ø����ʱ�ʾ�ķ�Ӧ������ʱ��Ĺ�ϵʾ������Ϊ��ͼ�е�������ţ� 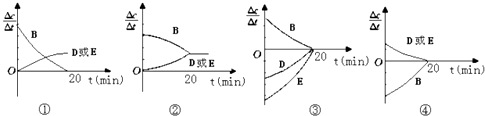
��4��ά��������������¶�T1���䣬����������м���1.60molB,0.20molD,0.20molE��nmolA���ﵽƽ����������20����ʱ�����ʵ�Ũ����ȫ��ͬʱ����Ͷ�����A�����ʵ���nȡֵ��Χmol��
��5��ά��������������¶�T1���䣬�����ʵ���ʼ���ʵ���Ϊ��n��A��=1.0mol��n��B��=3.0mol��n��D��=amol��n��E��=0mol���ﵽƽ���n��E��=0.50mol����a= ��
��6�������ܱ��������ȣ�ʵ����B��ת����B%��ʱ��仯��ʾ��ͼ��ͼ��ʾ��ͼ��֪��Q0������ڡ���С�ڡ�����c��v��v�棨����ڡ�����С�ڡ����ڡ�����