��Ŀ����
����Ŀ����ҵ�������ѵ���ԭ��NO(g)+NO2(g)+2NH3(g)![]() 2N2(g)+3H2O(g)+Q(Q��0)
2N2(g)+3H2O(g)+Q(Q��0)
��1���÷�Ӧ��ѧƽ�ⳣ��K�ı���ʽΪ___�����ƽ�ⳣ��Kֵ����___�������Ӧ�����淴Ӧ����������Ӱ�����
��2������Ӧ�ں��������½��У���˵����Ӧ�Ѿ��ﵽƽ��״̬����___������ţ�
a�������ڻ������������� b�������������ѹǿ����
c����Ӧ����0.5molNO��ͬʱ����1molN2 d��NO2��Ũ�Ȳ���
��3����2L�ܱ������м��뷴Ӧ�10 min��ﵽƽ�⣬���ƽ��ʱ�������ʵ���������0.2mol������H2O(g)��ʾ��ƽ����Ӧ����Ϊ___��
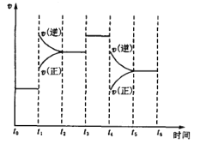
��4����ͼ��P1ѹǿ��NO��ת�����淴Ӧʱ�䣨t���ı仯ͼ������ͼ�л�������������������£�ѹǿΪP2(P2��P1)��NO��ת�����淴Ӧʱ��仯��ʾ��ͼ��___

��5��д����Ӧ���еİ����ĵ���ʽ___����ռ乹��Ϊ__������������������NH4Cl��NH4Cl��Һ��___�ԣ������½��������Ũ�ȵİ�ˮ��NH4Cl��Һ��ϣ�pH��7����Һ��NH3��H2O��H+��OH-��NH4+��Cl-Ũ���ɴ�С�Ĺ�ϵ��__��
���𰸡�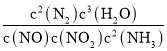 �淴Ӧ bd 0.015 mol/(Lmin)
�淴Ӧ bd 0.015 mol/(Lmin) 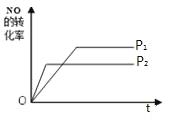
![]() ������ �� c(NH4+)��c(Cl-)��c(NH3H2O)��c(OH-)��c(H+)
������ �� c(NH4+)��c(Cl-)��c(NH3H2O)��c(OH-)��c(H+)
��������
(1)����ƽ�ⳣ����������ƽ��Ũ���ݴη��˻��뷴Ӧ��ƽ��Ũ���ݴη��˻��ı�ֵ��д���÷�ӦΪ���ȷ�Ӧ������¶ȶ�ƽ�ⳣ����Ӱ������жϣ�
(2)���ݿ��淴Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ�����ֵ�Ũ�Ȳ��ٱ仯�����жϣ�
(3)�ȼ��㵪���Ļ�ѧ��Ӧ���ʣ��ٸ��ݻ�ѧ����ʽ����v(H2O)��
(4)����ѹǿ��ƽ�������ƶ���NO ��ת���ʼ�С��ѹǿԽ��Ӧ���ʴﵽƽ������ʱ��Խ�٣��ݴ˷������
(5)NH3���ڹ��ۻ���������д���3�Թ��õ��Ӷԣ���ԭ�������Ϊ8�����ӣ��Ȼ����ǿ�������Σ��������ˮ��Ĺ����жϣ������½��������Ũ�ȵİ�ˮ��NH4Cl��Һ��ϣ�pH��7��˵��һˮ�ϰ�����̶ȴ���笠����ӵ�ˮ��̶ȣ��ݴ˷������
(1)NO(g)+NO2(g)+2NH3(g)2N2(g)+3H2O(g)+Q(Q��0)����Ӧ��ƽ�ⳣ��K=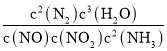 ���÷�ӦΪ���ȷ�Ӧ������ƽ�������ȷ�Ӧ������У�ƽ��������У����ƽ�ⳣ�� K ֵ����˵���ǽ����¶ȣ�ƽ��������У����淴Ӧ���ʾ���С�����淴Ӧ���ʼ�С�ij̶ȸ����淴Ӧ����Ӱ����ʴ�Ϊ��K=
���÷�ӦΪ���ȷ�Ӧ������ƽ�������ȷ�Ӧ������У�ƽ��������У����ƽ�ⳣ�� K ֵ����˵���ǽ����¶ȣ�ƽ��������У����淴Ӧ���ʾ���С�����淴Ӧ���ʼ�С�ij̶ȸ����淴Ӧ����Ӱ����ʴ�Ϊ��K=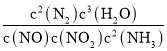 ���淴Ӧ��
���淴Ӧ��
(2)��ӦNO(g)+NO2(g)+2NH3(g)2N2(g)+3H2O(g)+Q(Q��0)�ں��������½��С�a�������ڻ���������ʼ�ղ��䣬�������䣬����˵���ﵽƽ��״̬����a����b����Ӧǰ���������ʵ��������仯���������������ѹǿ���䣬˵����������ʵ������䣬���淴Ӧ������ȣ���Ӧ�ﵽƽ��״̬����b��ȷ��c����Ӧ���� 0.5mol NO ��ͬʱ���� 1mol N2��ֻ��˵����Ӧ������У�����˵����Ӧ�ﵽƽ��״̬����c����d��NO2��Ũ�Ȳ��䣬˵����ƽ���־����d��ȷ���ʴ�Ϊ��bd��
(3)�� 2L �ܱ������м��뷴Ӧ�10min ��ﵽƽ�⣬���ƽ��ʱ���������ʵ��������� 0.2mol������N2(g)��ʾ��ƽ����Ӧ����v(N2)= =0.01 mol/(Lmin)����v(H2O)=
=0.01 mol/(Lmin)����v(H2O)=![]() v(N2)=
v(N2)= ![]() ��0.01 mol/(Lmin)=0.015 mol/(Lmin)���ʴ�Ϊ��0.015 mol/(Lmin)��
��0.01 mol/(Lmin)=0.015 mol/(Lmin)���ʴ�Ϊ��0.015 mol/(Lmin)��
(4)ѹǿΪP2(P2��P1)�£�����ѹǿ��ƽ�������ƶ���NO ��ת���ʼ�С��ѹǿԽ��Ӧ���ʴﵽƽ������ʱ��Խ�٣��ȴﵽƽ��״̬��ͼ��Ϊ�� ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
(5)NH3���ڹ��ۻ�������������Ӽ��������д���3�Թ��õ��Ӷԣ���ԭ�������Ϊ8�����ӣ���NH3�ĵ���ʽΪ��![]() ��Nԭ�Ӳ���sp3�ӻ����ռ乹��Ϊ�����Σ��Ȼ��Ϊǿ�������Σ�笠�����ˮ�⣬��Һ�����ԣ������½��������Ũ�ȵİ�ˮ��NH4Cl��Һ��ϣ�pH��7��˵��һˮ�ϰ�����̶ȴ���笠����ӵ�ˮ��̶ȣ���Һ��NH3H2O��H+��OH-��NH4+��Cl һŨ���ɴ�С�Ĺ�ϵ����Һ������Ũ�ȴ�СΪ��c(NH4+)��c(Cl-)��c(NH3H2O)��c(OH-)��c(H+)���ʴ�Ϊ��
��Nԭ�Ӳ���sp3�ӻ����ռ乹��Ϊ�����Σ��Ȼ��Ϊǿ�������Σ�笠�����ˮ�⣬��Һ�����ԣ������½��������Ũ�ȵİ�ˮ��NH4Cl��Һ��ϣ�pH��7��˵��һˮ�ϰ�����̶ȴ���笠����ӵ�ˮ��̶ȣ���Һ��NH3H2O��H+��OH-��NH4+��Cl һŨ���ɴ�С�Ĺ�ϵ����Һ������Ũ�ȴ�СΪ��c(NH4+)��c(Cl-)��c(NH3H2O)��c(OH-)��c(H+)���ʴ�Ϊ��![]() �������Σ��c(NH4+)��c(Cl-)��c(NH3H2O)��c(OH-)��c(H+)��
���������c(NH4+)��c(Cl-)��c(NH3H2O)��c(OH-)��c(H+)��