题目内容
19.下列物质中,与水反应剧烈程度最强的是( )| A. | Li | B. | Na | C. | K | D. | Cs |
分析 在碱金属中,金属性随着原子序数增大而增强,碱金属的金属性越强,其单质与水反应越剧烈,据此分析解答.
解答 解:在碱金属中,金属性随着原子序数增大而增强,碱金属的金属性越强,其单质与水反应越剧烈,金属性Cs>K>Na>Li,所以与水反应剧烈程度最强的是Cs,故选D.
点评 本题考查碱金属的性质,明确同一主族元素性质递变规律是解本题关键,知道金属性强弱判断方法,不能根据失电子多少判断,要根据失电子难易程度判断.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
9.下列说法正确的是( )
| A. | 雷雨天气时空气中能生成少量的氮氧化物,属于氮的固定 | |
| B. | 实验室用氯化铵溶液和氢氧化钙溶液混合制取氨气 | |
| C. | 铵盐化学性质都很稳定 | |
| D. | O2、NO、NO2都能用浓硫酸干燥,且通常情况下能共存 |
10.室温下,下列有机物在水中的溶解度最大的是( )
| A. | 甲苯 | B. | 丙三醇 | C. | 苯酚 | D. | 1-氯丁烷 |
7.下列反应中的能量转化不正确的是( )
| 选项 | 化学反应 | 能量转化形式 |
| A | CH4+2O2 $\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O | 化学能转化成热能 |
| B | Pb+PbO2+2H2SO4 $?_{放电}^{充电}$2PbSO4+2H2O | 使用时放电,电能转化成化学能 |
| C | mH2O+nCO2 $→_{叶绿体}^{光}$Cn(H2O)m+O2 | 光能转化成化学能 |
| D | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | 热能转化成化学能 |
| A. | A | B. | B | C. | C | D. | D |
4.将CO2转化成有机物可有效地实现碳循环.原子利用率为目标产物的总质量与全部反应物的总质量之比,则以下反应中理论上原子利用率最高的是( )
| A. | CO2+CH4$→_{△}^{催化剂}$CH3COOH | |
| B. | 2CO2+6H2$→_{△}^{催化剂}$C2H5OH十3H2O | |
| C. | 2CO2+6H2$→_{△}^{催化剂}$CH2=CH2+4H2O | |
| D. | 6CO2+6H2O$\stackrel{光照/叶绿素}{→}$C6H12O6+6O2 |
11.铋(Bi)在医药方面有重要应用.${\;}_{83}^{209}$Bi与${\;}_{83}^{210}$Bi的关系是( )
| A. | 同一种核素 | B. | 互为同分异构体 | C. | 互为同素异形体 | D. | 互为同位素 |
9.在相同温度下,体积均为2.5L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)?2NH3(g)△H=-92.6kJ•mol-1实验测得起始、平衡时的有关数据如下表,下列叙述错误的是( )
| 容器编号 | 起始各物质的物质的量(mol) | 达到平衡时能量变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出23.15kJ能量 |
| ② | 0.9 | 2.7 | 0.2 | 放出QkJ能量 |
| A. | 容器①、②中反应的化学平衡常数相等 | |
| B. | 平衡时,两容器中氨的体积分数均约为14.3% | |
| C. | 反应②达到平衡时,放出的热量Q=23.15 kJ | |
| D. | 若①的体积为5.0 L,则达到平衡时放出的热量小于23.15 kJ |
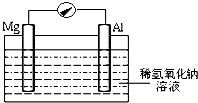 近年来,镁在汽车、航空、航天、机械制造、军事等产业中应用迅猛发展.
近年来,镁在汽车、航空、航天、机械制造、军事等产业中应用迅猛发展.