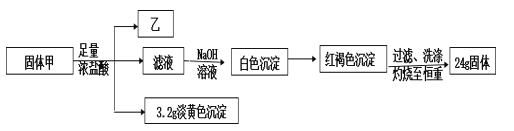
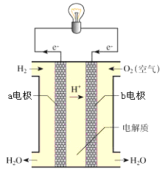
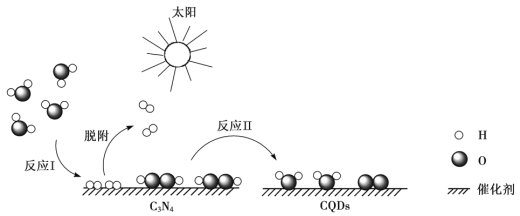
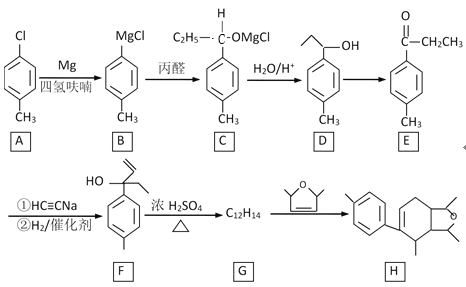
题目内容
【题目】H2S与CO2在高温下发生反应:CO2 (g) + H2S (g) ![]() COS (g) + H2O (g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。下列说法不正确的是
COS (g) + H2O (g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。下列说法不正确的是
A. 升高温度,H2S浓度增加,表明该反应是放热反应
B. 通入CO2后,正反应速率先增大后减小
C. H2S的平衡转化率α = 4.5 %
D. 反应平衡常数K = 2.8×10-3
【答案】C
【解析】
列出反应三段式:
CO2 (g) + H2S (g) ![]() COS (g) + H2O (g)
COS (g) + H2O (g)
n起始/mol 0.10 0.40 0 0
n转化/mol x x x x
n平衡/mol 0.10-x 0.40-x x x
反应平衡后水的物质的量分数为0.02,则x/0.50=0.02,x=0.01,
A. 升高温度,H2S浓度增加,说明升温平衡逆向移动,则表明正反应是放热反应,故A正确;
B. 通入CO2后,增大反应物浓度,正反应速率增大,随着反应进行,反应物浓度又逐渐减小,所以正反应速率先增大后减小,故B正确;
C. 根据以上计算数据,H2S的平衡转化率α =![]() ×100%= 2.5 %,故C错误;
×100%= 2.5 %,故C错误;
D. 根据以上计算数据,反应平衡常数K = ![]() =
= =2.8×10-3,故D正确。
=2.8×10-3,故D正确。
答案选C。

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案【题目】通过下表的相关数据,计算、分析、判断给出结论,题目所给数据和条件均为常温下,
NH3H2O | Kb=1.8×10-5 |
H2CO3 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
HF | Ka=6.8×10-4 |
H2S | Ka1=1.3×10-7 Ka2=7.1×10-15 |
H2O | Kw=10-14 |
Cu(OH)2 | Ksp=2.2×10-20 |
Fe(OH)3 | Ksp=4.0×10-38 |
CuS | Ksp=6.3×10-36 |
FeS | Ksp=3.6×10-18 |
常用对数 | lg2=0.3 lg2.2=0.34 lg3=0.48 |
(1)NH4F 溶液显____性,保存此溶液应该放在__________中。
(2)NH4HCO3 溶液与少量 NaOH 溶液反应时,_____ (填离子符号)先与 NaOH 溶液中的 OH-反应。
(3)向含Fe3+和Cu2+均为0.1mol/L的溶液中加入某碱调节pH=___时,Fe3+完全沉淀,当pH=_____时,Cu2+开始沉淀,
(4)反应 CuS(s) + H2SO4(aq)![]() H2S(aq) + CuSO4(aq)的 K= _____________;反应 FeS(s) + H2SO4(aq)
H2S(aq) + CuSO4(aq)的 K= _____________;反应 FeS(s) + H2SO4(aq) ![]() H2S(aq) + FeSO4 (aq)的 K=___________;反应 CuS(s)+Fe2+(aq)
H2S(aq) + FeSO4 (aq)的 K=___________;反应 CuS(s)+Fe2+(aq)![]() FeS(s)+Cu2+(aq)的 K=_______
FeS(s)+Cu2+(aq)的 K=_______
由计算结果可以知道:实验室制备H2S气体应选用_________,检验H2S气体应选用_________(均用上述反应中的盐类物质作答)
除去废水中的 Cu2+使用 过量的 FeS 固体的优点有:
a.可以除去废水中的 Cu2+,过量的 FeS 和生成的 CuS 可以通过过滤一并除去
b.____________________________________________________________________