题目内容
【题目】对于氢氧燃料电池,下列说法正确的是( )
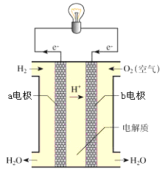
A.用 KOH 做电解质,负极反应是 H2-2e-+2OH-=2H2O
B.电子从 a 电极通过外电路到 b 电极最终移到 a 电极形成闭合回路
C.原电池不能将化学能百分之百转化成电能
D.氢氧燃料电池在使用过程中会看到淡蓝色火焰
【答案】AC
【解析】
根据燃料电池原理图分析可知,电子由a极移向b极,则a极为原电池的负极,H2失去电子发生氧化反应,b极为原电池的正极,O2得到电子发生还原反应,据此分析解答;
A.用KOH做电解质,负极产生的H+与OH-结合生成H2O,则负极反应式为H2-2e-+2OH-=2H2O,A选项正确;
B.电子只能在外电路中移动,电子从a电极通过外电路到b电极,不能再从b电极移到a电极,B选项错误;
C.原电池不可能把化学能完全转化为电能,其间一定有能量损耗,比如氧化还原过程放热等,C选项正确;
D.燃料电池是利用燃料发生氧化还原反应将化学能转化为电能,不是燃烧,不会看到蓝色火焰,D选项错误;
答案选AC。

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目