题目内容
【题目】下列说法正确的是
A. 25℃时,等物质的量浓度、等体积的NH4HSO4溶液和NaOH溶液混合:
c(Na+)=c(SO4-)>c(NH4+)>c(H+)>c(OH-)
B. 25℃时,0.1mol L-1的HA溶液中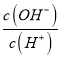 = 1×10-8,则该溶液中由水电离出的c(H+)=l×10-3mol·L-1
= 1×10-8,则该溶液中由水电离出的c(H+)=l×10-3mol·L-1
C. 25℃时,对于pH相同的弱碱ROH和MOH(前者的电离平衡常数Kb较小),加水稀释后溶液的pH仍相同,则后者稀释的倍数更大
D. 25℃时,沉淀溶解平衡:BaSO4(s)![]() Ba2+(aq)+SO42-(aq)的Ksp为1.1×10-10,说明BaSO4是弱电解质
Ba2+(aq)+SO42-(aq)的Ksp为1.1×10-10,说明BaSO4是弱电解质
【答案】A
【解析】A、等物质的量浓度、等体积的NH4HSO4溶液和NaOH溶液混合,反应生成Na2SO=、H2O、(NH4)2SO4;Na+、SO42-不水解,故c(Na+)=c(SO42-),NH4+水解显酸性,所以c(H+)>c(OH-),即离子浓度由大到小为:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-),选项A正确;B、 25℃时,0.1mol L-1的HA溶液中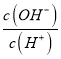 = 1×10-8,Kw=c(H+) c(OH-)=l×10-14,则该溶液中由水电离出的c(H+)=l×10-11mol·L-1,选项B错误;C、25℃时,对于pH相同的弱碱ROH和MOH(前者的电离平衡常数Kb较小),加水稀释后溶液的pH仍相同,碱越弱所加的水应该越多,则前者稀释的倍数更大,选项C错误;D、不能以溶度积的大小来说明电解质的强弱,BaSO4是在水溶液中全部电离成离子的化合物,属于强电解质,选项D错误。答案选A。
= 1×10-8,Kw=c(H+) c(OH-)=l×10-14,则该溶液中由水电离出的c(H+)=l×10-11mol·L-1,选项B错误;C、25℃时,对于pH相同的弱碱ROH和MOH(前者的电离平衡常数Kb较小),加水稀释后溶液的pH仍相同,碱越弱所加的水应该越多,则前者稀释的倍数更大,选项C错误;D、不能以溶度积的大小来说明电解质的强弱,BaSO4是在水溶液中全部电离成离子的化合物,属于强电解质,选项D错误。答案选A。

 一课一练课时达标系列答案
一课一练课时达标系列答案 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案【题目】将绿豆大小的方形金属钠投入足量且含酚酞的水中,根据相应现象不能得出的结论是( )
选项 | 实验现象 | 结论 |
A | 方形金属钠变成小球 | 钠与水的反应吸热 |
B | 钠浮于水面游动 | 水的密度大于钠的 |
C | 酚酞溶液变成红色 | 有碱性物质生成 |
D | 钠球游动有吱吱声 | 有气体生成 |
A. A B. B C. C D. D