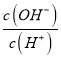题目内容
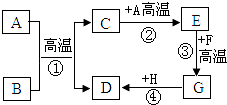
【题目】焦亚硫酸钠(Na2S2O5)是一种食品添加剂。实验室用如图所示装置制备Na2S2O5,实验步骤如下:

Ⅰ.向Na2CO3溶液中通入SO2至溶液pH为4.1,生成NaHSO3溶液;
Ⅱ.加入碳酸钠粉末至溶液PH为7~8;
Ⅲ.再通入SO2至溶液PH为4.1;
Ⅳ.从过饱和溶液中析出Na2S2O5晶体。
(1)制备焦亚硫酸钠总反应的化学方程式为___________________ 。
(2)Na2S2O5能与水发生化合反应,反应后所得的溶液显酸性。用电离方程式表示溶液显酸性的原因:____________________。
(3)利用碘量法可测定Na2S2O5产品中硫的含量。实验中必须使用的试剂有c1mol·L-1的标准碘溶液、c2 mol·L-1的标准Na2S2O3溶液、NaOH溶液、淀粉溶液。已知:Na2S2O5+2I2+3H2O=Na2SO4+H2SO4+4HI,2Na2S2O3+I2= Na2S2O6+2NaI。请补全实验方案:将一定量的Na2S2O5产品放入碘量瓶(带磨口塞的锥形瓶)中,加入—定体积的过量c1 mol L-1的标准碘溶液,充分反应后滴入NaOH溶液调节溶液pH至中性,____________________________。重复上述步骤2次,记录数据。
(4)含铬酸性废水中常含有+ 6价铬。利用Na2S2O5和FeSO4·7H2O分两个阶段先后处理含Cr2O72-的废水, Cr2O72-被还原为Cr3+,实验结果如图。

①0~40 min内用Cr2O72-表示的平均反应速率为____________mol L-1 min-1。
②60~80 min内Cr2O72-与Fe2+发生反应的离子方程式为_________________ 。
【答案】 Na2CO3+2SO2=Na2S2O5+CO2 NaHSO3=Na++HSO3-、HSO3-![]() H++SO32-(只写 HSO3-
H++SO32-(只写 HSO3-![]() H++S O32-也给分) 加入淀粉溶液,用c2mol L-1的标准Na2SO3溶液滴定至溶液由蓝色恰好变为无色,且半分钟内不变色,读数 1.75×10-3 Cr2O72-+ 6Fe2++14H+=2Cr3++6Fe3++7H2O
H++S O32-也给分) 加入淀粉溶液,用c2mol L-1的标准Na2SO3溶液滴定至溶液由蓝色恰好变为无色,且半分钟内不变色,读数 1.75×10-3 Cr2O72-+ 6Fe2++14H+=2Cr3++6Fe3++7H2O
【解析】(1)Na2CO3和SO2反应生成Na2S2O5和CO2,根据元素守恒可知化学方程式为:Na2CO3+2SO2=Na2S2O5+CO2;(2)Na2S2O5与水反应生成NaHSO3,NaHSO3在水中电离程度大于水解程度,所以使溶液显酸性:NaHSO3=Na++HSO3-、HSO3-![]() H++SO32-;(3)根据氧化还原滴定原理,在Na2S2O5溶液中加入过量的标准碘溶液,使Na2S2O5被充分氧化,剩余的标准碘溶液再用标准Na2S2O5溶液滴定,根据加入的碘的总量和与Na2S2O5溶液反应的碘的量可以求得与Na2S2O5反应的碘的量,进而确定Na2S2O5的量,根据这一原理可知实验操作步骤为:将一定量的Na2S2O5产品放入碘量瓶(带磨口塞的锥形瓶)中,加入—定体积的过量c1 mol L-1的标准碘溶液,充分反应后滴入NaOH溶液调节溶液pH至中性,加入淀粉溶液,用c2mol L-1的标准Na2SO3溶液滴定至溶液由蓝色恰好变为无色,且半分钟内不变色,读数,重复上述步骤2次,记录数据;(4)①0~40 min内Cr2O72-的浓度变化量为:0.08mol/L-0.01mol/L=0.07mol/L,则平均反应速率为
H++SO32-;(3)根据氧化还原滴定原理,在Na2S2O5溶液中加入过量的标准碘溶液,使Na2S2O5被充分氧化,剩余的标准碘溶液再用标准Na2S2O5溶液滴定,根据加入的碘的总量和与Na2S2O5溶液反应的碘的量可以求得与Na2S2O5反应的碘的量,进而确定Na2S2O5的量,根据这一原理可知实验操作步骤为:将一定量的Na2S2O5产品放入碘量瓶(带磨口塞的锥形瓶)中,加入—定体积的过量c1 mol L-1的标准碘溶液,充分反应后滴入NaOH溶液调节溶液pH至中性,加入淀粉溶液,用c2mol L-1的标准Na2SO3溶液滴定至溶液由蓝色恰好变为无色,且半分钟内不变色,读数,重复上述步骤2次,记录数据;(4)①0~40 min内Cr2O72-的浓度变化量为:0.08mol/L-0.01mol/L=0.07mol/L,则平均反应速率为![]() =1.75×10-3molL-1min-1;②Cr2O72-与Fe2+在H+作用下生成Cr3+、Fe3+和H2O,反应的离子方程式为:Cr2O72-+ 6Fe2++14H+=2Cr3++6Fe3++7H2O。
=1.75×10-3molL-1min-1;②Cr2O72-与Fe2+在H+作用下生成Cr3+、Fe3+和H2O,反应的离子方程式为:Cr2O72-+ 6Fe2++14H+=2Cr3++6Fe3++7H2O。

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案