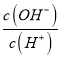题目内容
【题目】碘是人类必需的生命元素,在人体的生长发育过程中起着重要作用。
Ⅰ. 人体碘的重要来源之一是食用加碘食盐(含KIO3)。为检测食盐中的KIO3,并测定加碘食盐样品的碘含量,某实验小组设计了如下实验:
①用天平准确称取w g食盐样品,加适量蒸馏水使其完全溶解。
②用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全生成I2。
③以淀粉为指示剂,逐滴加入浓度为2.0×10-3 mol·L-1的Na2S2O3溶液6.00 mL,恰好反应完全。(已知:I2+2S2O32-= 2I-+S4O62-)
(1)书写步骤②中反应的离子方程式:_______________________________。
(2)步骤③中判断反应恰好完全的现象是_____________________________。
(3)上述实验样品中碘元素的含量是_________________mg/g(以含w的代数式表达)。
Ⅱ.海带或海苔中含有丰富的碘元素,也是人体碘的一种来源。下图是实验室从海带
(含I-)中提取碘单质的流程图。

(1)步骤①中灼烧海带用到的实验仪器是__________(填序号)。
a.坩埚 b.试管 c.蒸发皿 d.烧杯
(2)步骤②的实验操作包括_____________。步骤④中分液所用的玻璃仪器是____、烧杯。
(3)步骤③中反应的离子方程式是_______________________________________。
【答案】 IO3-+5I-+6H+=3I2+3H2O 溶液蓝色变为无色 ![]() a 溶解和过滤 分液漏斗 H2O2+2I-+2H+=I2+2H2O
a 溶解和过滤 分液漏斗 H2O2+2I-+2H+=I2+2H2O
【解析】Ⅰ.(1)酸性条件下,碘酸根离子和碘离子发生氧化还原反应生成碘单质,离子反应方程式为:IO3-+5I-+6H+=3I2+3H2O;(2)碘遇淀粉试液变蓝色,如果溶液中不存在碘单质,则溶液蓝色变为无色;(3)IO3-+5I-+6H+=3I2+3H2O、I2+2 S2O32-=2I-+S4O62-,设碘酸钾中碘的质量是x,根据反应可得关系为:
IO3-~~~~3I2~~~~~6 S2O32-,
127g 6mol
x 2.0×10-3 molL-1×0.006L
x=![]() =0.254mg,每w g食盐中含有0.254mg碘,则样品中碘元素的含量是
=0.254mg,每w g食盐中含有0.254mg碘,则样品中碘元素的含量是![]() mg/g;
mg/g;
Ⅱ.(1)步骤①中灼烧海带用到的实验仪器是坩埚,答案选a;(2)步骤②的实验操作包括将海带灰溶解,然后过滤掉不溶物,故答案为:溶解和过滤;步骤④中分液所用的玻璃仪器是分液漏斗、烧杯;(3)步骤③中是利用双氧水将碘离子氧化为碘单质,其反应的离子方程式是H2O2+2I-+2H+=I2+2H2O。