题目内容
【题目】CO、CO2是化石燃料燃烧的主要产物。
(1)将含0.02 molCO2和0.01molCO的混合气体通入有足量Na2O2 固体的密闭容器中,同时不断地用电火花点燃,充分反应后,固体质量增加_________g。
(2)已知:2CO(g)+O2(g)=2CO2(g) △H=-566.0 kJ·mol-1,键能Eo-o=499.0kJ·mol-1。
①反应:CO(g)+O2(g)![]() CO2(g)+O(g)的△H=_________kJ·mol-1。
CO2(g)+O(g)的△H=_________kJ·mol-1。
②已知2500K时,①中反应的平衡常数为0.40,某时刻该反应体系中各物质浓度满足:c(CO)·c(O2)=c(CO2)·c(O),则此时v(正)_________(填“>” 、“<”或“=”)v(逆)。
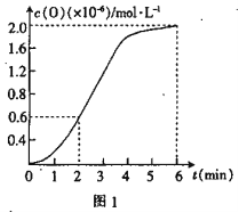
③已知1500℃时,在密闭容器中发生反应:CO2(g)![]() CO(g)+O(g)。反应过程中O(g)的 物质的量浓度随时间的变化如图1 所示,则0~2 min 内,CO2 的平均反应速率 v(CO2)=_________。
CO(g)+O(g)。反应过程中O(g)的 物质的量浓度随时间的变化如图1 所示,则0~2 min 内,CO2 的平均反应速率 v(CO2)=_________。
(3)在某密闭容器中发生反应:2CO2(g)![]() 2CO(g)+O2(g),1molCO2 在不同温度下的平衡分解量如图2 所示。
2CO(g)+O2(g),1molCO2 在不同温度下的平衡分解量如图2 所示。

①恒温恒容条件下,能表示该可逆反应达到平衡状态的有_________ (填字母)。
A.CO 的体积分数保持不变
B.容器内混合气体的密度保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.单位时间内,消耗CO 的浓度等于生成CO2 的浓度
②分析图2,若1500℃时反应达到平衡状态,且容器体积为1L,则此时反应的平衡常数 K=_________(计算结果保留1 位小数)。
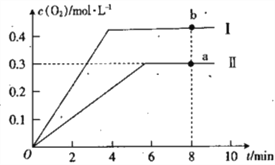
③向恒容密闭容器中充入2molCO2(g),发生反应:2CO2(g)![]() 2CO(g)+O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II 所示。图中曲线I 示相对于曲线II仅改变一种反应条件后c(O2)随时间的变化,则改变的条件是_________;a、 两点用CO浓度变化表示的净反应速率关系为va(CO)_________(填“>”“<”或“=”) vb( CO)。
2CO(g)+O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II 所示。图中曲线I 示相对于曲线II仅改变一种反应条件后c(O2)随时间的变化,则改变的条件是_________;a、 两点用CO浓度变化表示的净反应速率关系为va(CO)_________(填“>”“<”或“=”) vb( CO)。
【答案】 0.84g -33.5 < 3×10-7mol·L-1·min-1 AC 3.2×10-8mol·L-1 升温 <
【解析】本题是化学反应原理的综合考查,主要涉及到焓变的计算、速率的计算、平衡常数的计算、平衡图像的分析、平衡移动等。(1)Na2O2与CO2反应:2CO2+2Na2O2=2Na2CO3+O2,电火花不断引燃,发生反应:2CO+O2![]() 2CO2,整个过程相当于CO+Na2O2=Na2CO3,故将含0.02 molCO2和0.01molCO的混合气体通入有足量Na2O2 固体的密闭容器中,同时不断地用电火花点燃,充分反应后,固体质量增加部分即相当于增加0.03molCO,固体质量增加为0.84g;(2)①根据△H=反应物的总键能-生成物的总键能,结合已知反应,得反应:CO(g)+O2(g)
2CO2,整个过程相当于CO+Na2O2=Na2CO3,故将含0.02 molCO2和0.01molCO的混合气体通入有足量Na2O2 固体的密闭容器中,同时不断地用电火花点燃,充分反应后,固体质量增加部分即相当于增加0.03molCO,固体质量增加为0.84g;(2)①根据△H=反应物的总键能-生成物的总键能,结合已知反应,得反应:CO(g)+O2(g)![]() CO2(g)+O(g)的△H=
CO2(g)+O(g)的△H=![]() kJ·mol-1=-33.5 kJ·mol-1;②c(CO)·c(O2)=c(CO2)·c(O),即Qc=1>K,平衡向逆反应方向移动,v(正)< v(逆);③根据化学反应之比等于化学计量数之比,再结合图像可知:v(CO2)= v(O)=
kJ·mol-1=-33.5 kJ·mol-1;②c(CO)·c(O2)=c(CO2)·c(O),即Qc=1>K,平衡向逆反应方向移动,v(正)< v(逆);③根据化学反应之比等于化学计量数之比,再结合图像可知:v(CO2)= v(O)= ![]() =3×10-7mol·L-1·min-1;(3)①CO的体积分数保持不变说明正逆反应速率相等,达到平衡状态,A项正确;密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此容器内混合气体的密度保持不变不能说明反应达到平衡状态,B项错误;混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,所以容器内混合气体的平均摩尔质量保持不变说明反应达到平衡状态,C项正确;单位时间内消耗CO的浓度始终等于生成CO2的浓度,反应速率同向,不能判定反应达到平衡状态,D项错误;②设生成的氧气为xmol:
=3×10-7mol·L-1·min-1;(3)①CO的体积分数保持不变说明正逆反应速率相等,达到平衡状态,A项正确;密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此容器内混合气体的密度保持不变不能说明反应达到平衡状态,B项错误;混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,所以容器内混合气体的平均摩尔质量保持不变说明反应达到平衡状态,C项正确;单位时间内消耗CO的浓度始终等于生成CO2的浓度,反应速率同向,不能判定反应达到平衡状态,D项错误;②设生成的氧气为xmol:
2CO2(g)![]() 2CO(g)+O2(g)
2CO(g)+O2(g)
起始量/mol 1 0 0
转化量/mol 2x 2x x
平衡量/mol1-2x 2x x
平衡时,氧气的体积分数为0.2,则![]() =0.2%,则x=0.002,则
=0.2%,则x=0.002,则
![]() ,
,![]() ,
,![]() ,
,
则![]() ;
;
③若曲线Ⅰ代表的是仅变化一种条件后的情况,曲线Ⅰ达到平衡所需时间少,说明反应速率快,且氧气的浓度增大,平衡正向进行,改变条件是升温;a、b两点后,a点温度小于b点,所以用CO浓度变化表示的反应速率关系为va(CO) <vb(CO).

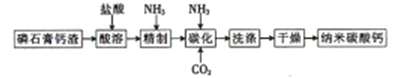
【题目】纳米碳酸钙是一种广泛应用于塑料、食品、医药、饲料等行业的重要无机填料。以磷石膏钙渣为原料制取高品质纳米碳酸钙的工艺流程如下:
已知某磷石膏钙渣的主要成分及其含量如下表所示。
CaO | P2O5 | SO3 | Fe2O3 | Al2O3 | SiO2 | 烧失量 |
47.70% | 1.60% | 1.77% | 0.041% | 0.0027% | 9.85% | 37.69% |
请回答下列问题:
(1)对磷石膏钙渣进行酸溶的目的是获得机制CaCl2溶液,为了提高溶出率,可以采取的措施有______。(回答两条即可)
(2)为了探究酸溶的工艺条件,称取6 份各50g磷石膏钙渣,分别用不同浓度盐酸进行溶解,反应时间为30 min,测得滤液中钙溶出率的结果如图所示,最适宜的盐酸浓度为_______。

(3)精制是向粗制CaCl2溶液中通入氨气,控制溶液的pH,主要除去________ (填金属阳离子)。
(4)碳化时,先将精制CaCl2溶液稀释至一定体积,控制反应温度以及NH3和CO2 的通入量,此过程中,通入气体有先后顺序,应先通入气体的化学式_______(填化学式);碳化时发生反应的化学方程式为______。
(5)把CaCO3浊液滴入1.0molL-1 的Na2SO3溶液中,能否产生CaSO3沉淀?_______。若不能,说明原因;若能,请从定量的角度简述判断依据:_______。[已知:Ksp(CaSO3)=1.4×10-7,Ksp(CaCO3)=2.8×10-9]
(6)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级:__________。
【题目】现使用酸碱中和滴定法测定市售白醋的总酸量(g100ml﹣1).
(1)Ⅰ.实验步骤:
用(填仪器名称)量取10.00mL食用白醋,在烧杯中用水稀释后转移到转移到 (填仪器名称)中定容,摇匀即得待测白醋溶液.
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴作指示剂.
(3)读取盛装0.1000mol/L NaOH溶液的碱式滴定管的初始读数.
滴定.当时,停止滴定,并记录NaOH溶液的终读数.重复滴定3次.
(4)Ⅱ.实验记录:
滴定次数 | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论:
甲同学在处理数据时计算得:平均消耗的NaOH溶液的体积V= ![]() mL=15.24mL.指出他的计算的不合理之处: .
mL=15.24mL.指出他的计算的不合理之处: .
(5)乙同学仔细研究了该品牌白醋的标签,发现其中还含有苯甲酸钠作为食品添加剂,他想用资料法验证醋酸与苯甲酸钠不会发生离子交换反应,需查找在一定温度下醋酸和苯甲酸的(填写序号)
a.电离常数 b.溶解度
(6)在本实验的滴定过程中,下列操作会使实验结果偏大的是(填写序号) .
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出.