题目内容
将0.15mol Fe3O4完全溶解在足量稀硫酸中,然后加入K2Cr2O7溶液250mL,恰好使溶液中Fe2+全部氧化成Fe3+,Cr2O72-全部转化成Cr3+,则K2Cr2O7溶液的物质的量浓度是
A.0.05mol/L B.0.1mol/L C.0.2mol/L D.0.3mol/L
【答案】
B
【解析】
试题分析:由Fe3O4+8H+=Fe2++2Fe3++4H2O可知,n(Fe2+)=n(Fe3O4)=0.15mol;由Fe2+—e—=Fe3+可知,n(e—)失去=n(Fe2+)=0.15mol;设n(K2Cr2O7)=xmol,铬元素由+6价降为+3价,则n(e—)得到=n(K2Cr2O7)×2×3=6xmol;由电子得失相等可知,6x=0.15,则x=0.025mol;由n/V可知c(K2Cr2O7)=0.025mol÷0.25L=0.1mol/L,B项正确。
考点:考查四氧化三铁与硫酸反应、亚铁离子的还原性、重铬酸钾的氧化性、电子守恒原理、物质的量在离子方程式计算中的应用、物质的量浓度等相关知识。

练习册系列答案
相关题目
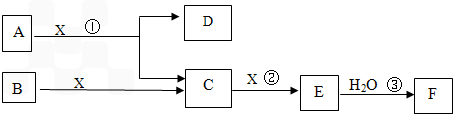
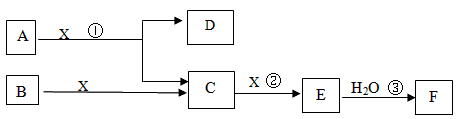
 (1)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,该反应的离子方程式为: 。
(1)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,该反应的离子方程式为: 。
 (3)为了探究铜与稀硝酸反应产生的气体主要是NO而设计了下列实验,装置如图所示
(3)为了探究铜与稀硝酸反应产生的气体主要是NO而设计了下列实验,装置如图所示
 4 molC和3 molX,10分钟后反应达到平衡,平衡时混合气体共6 mol,则下列说法正确的是
4 molC和3 molX,10分钟后反应达到平衡,平衡时混合气体共6 mol,则下列说法正确的是  提高C的转化率
提高C的转化率