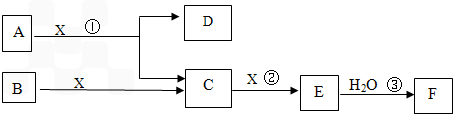
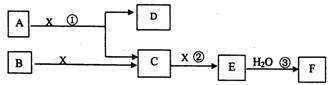
��Ŀ����
��ͼ��A��B��Ϊ���壬����BΪ���ʡ���ͼ�����ڹ�ҵ����F��F�Ǻ���һ�����һ���ˮƽ�ı�־��
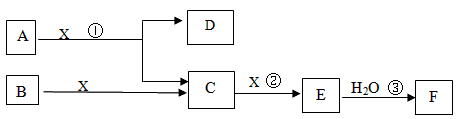
�ش��������⣺
��1��A�Ļ�ѧʽ____________
��2����Ӧ����һ��������ԭ��Ӧ���÷�Ӧ����ʱ��ÿ����4 mol����C��ת�Ƶ���____________mol
��3��д��D�������ʷ�Ӧ�Ļ�ѧ����ʽ_____________
��4����Ӧ���ǿ��淴Ӧ����2 L���ܱ�������Ͷ��4 molC��3 molX,10���Ӻ�Ӧ�ﵽƽ��,ƽ��ʱ������干6 mol,������˵����ȷ����_____________
A����ҵ��ȡFʱ,C��X����E�ķ�Ӧ��������������
B����10������,X��ƽ��������0.1mol/( L��min)
C����C��X���������ʱ�Ϊ2:1ʱ,��־�ŷ�Ӧ�ﵽƽ��
D��ƽ��ʱC��ת������50% E���ڹ�ҵ�����п���ͨ������X���������C��ת����
F����ҵ������ֱ����ˮ������E
��5��д��2.24L����C��0.15mol����������Һ��Ӧ�����ӻ�ѧ����ʽ______________��
��6����5 mL 0.02mol/L��F��Һ��5 mL 0.02 mol/LNaOH��Һ��ֻ�ϣ�����Ϻ���Һ�����Ϊ10mL������Һ��pH��__________д��F��һ����;_______________��
��1��A�Ļ�ѧʽ____________
��2����Ӧ����һ��������ԭ��Ӧ���÷�Ӧ����ʱ��ÿ����4 mol����C��ת�Ƶ���____________mol
��3��д��D�������ʷ�Ӧ�Ļ�ѧ����ʽ_____________
��4����Ӧ���ǿ��淴Ӧ����2 L���ܱ�������Ͷ��4 molC��3 molX,10���Ӻ�Ӧ�ﵽƽ��,ƽ��ʱ������干6 mol,������˵����ȷ����_____________
A����ҵ��ȡFʱ,C��X����E�ķ�Ӧ��������������
B����10������,X��ƽ��������0.1mol/( L��min)
C����C��X���������ʱ�Ϊ2:1ʱ,��־�ŷ�Ӧ�ﵽƽ��
D��ƽ��ʱC��ת������50% E���ڹ�ҵ�����п���ͨ������X���������C��ת����
F����ҵ������ֱ����ˮ������E
��5��д��2.24L����C��0.15mol����������Һ��Ӧ�����ӻ�ѧ����ʽ______________��
��6����5 mL 0.02mol/L��F��Һ��5 mL 0.02 mol/LNaOH��Һ��ֻ�ϣ�����Ϻ���Һ�����Ϊ10mL������Һ��pH��__________д��F��һ����;_______________��
��1��FeS2
��2�� 22mol mol
��3��
��4��D��E
��5��2SO2 + 3NaOH = NaHSO3 + Na2SO3
��6��2 ������ԭ�ϡ��Ʒ��ϡ��ӹ������ȣ��������ɣ�
��2�� 22mol mol
��3��

��4��D��E
��5��2SO2 + 3NaOH = NaHSO3 + Na2SO3
��6��2 ������ԭ�ϡ��Ʒ��ϡ��ӹ������ȣ��������ɣ�

��ϰ��ϵ�д�
�����Ŀ