题目内容
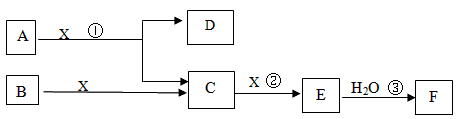
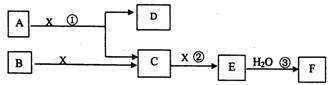
下图中A、B均为固体,其中B为单质。下图可用于工业生产F,F是衡量一个国家化工水平的标志。回答下列问题
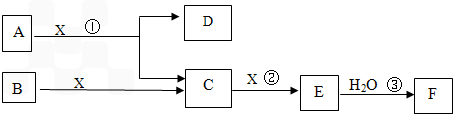
(1)A的化学式 ___________
(2)反应①是一个氧化还原反应,该反应发生时,每生成4 mol气体C,转移电子_____mol
(3)写出D与铝单质反应的化学方程式 ___________________
(4)反应②是可逆反应,在2 L的密闭容器中投入4 molC和3 molX,10分钟后反应达到平衡,平衡时混合气体共6 mol,则下列说法正确的是________
A.工业制取F时,C和X生成E的反应是在吸收塔进行
B.这10分钟内,X的平均速率是0.1mol/( L·min)
C.当C和X的消耗速率比为2:1时,标志着反应达到平衡
D.平衡时C的转化率是50%
E.在工业生产中可以通过增加X的量来提高C的转化率
F.工业生产中直接用水来吸收E
(5)写出2.24L气体C与0.15mol氢氧化钠溶液反应的离子化学方程式_____________
(6)将5 mL 0.02mol/L的F溶液与5 mL 0.02 mol/LNaOH溶液充分混合,若混合后溶液的体积为10mL,则混合液的pH是_________写出F的一种用途_______________
(2)反应①是一个氧化还原反应,该反应发生时,每生成4 mol气体C,转移电子_____mol
(3)写出D与铝单质反应的化学方程式 ___________________
(4)反应②是可逆反应,在2 L的密闭容器中投入4 molC和3 molX,10分钟后反应达到平衡,平衡时混合气体共6 mol,则下列说法正确的是________
A.工业制取F时,C和X生成E的反应是在吸收塔进行
B.这10分钟内,X的平均速率是0.1mol/( L·min)
C.当C和X的消耗速率比为2:1时,标志着反应达到平衡
D.平衡时C的转化率是50%
E.在工业生产中可以通过增加X的量来提高C的转化率
F.工业生产中直接用水来吸收E
(5)写出2.24L气体C与0.15mol氢氧化钠溶液反应的离子化学方程式_____________
(6)将5 mL 0.02mol/L的F溶液与5 mL 0.02 mol/LNaOH溶液充分混合,若混合后溶液的体积为10mL,则混合液的pH是_________写出F的一种用途_______________
(1)FeS2
(2)22mol
(3)2Al + Fe2O3 2Fe + Al2O3
2Fe + Al2O3
(4)DE
(5)2SO2 + 3NaOH = NaHSO3 + Na2SO3
(6)2;化工原料、制肥料、加工金属等
(2)22mol
(3)2Al + Fe2O3
 2Fe + Al2O3
2Fe + Al2O3(4)DE
(5)2SO2 + 3NaOH = NaHSO3 + Na2SO3
(6)2;化工原料、制肥料、加工金属等

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目