题目内容
盐酸、硫酸和硝酸是中学阶段常见的三种强酸。请根据三者与金属铜的反应情况,回答下列问题:
 (1)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,该反应的离子方程式为: 。
(1)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,该反应的离子方程式为: 。
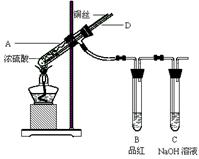
(2)如右图所示,进行铜与浓硫酸的反应:
①B中的实验现象为 。
②拆除装置前,不需打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是:
。
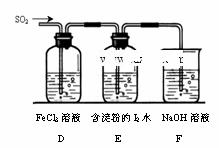
③若将如右装置连接在上述装置B之后,
其中下列说法不合理的是 (填序号)。
a.能表明I-的还原性强于SO2的现象是E中
蓝色溶液褪色
b.装置F的作用是吸收SO2尾气,防止污染空气
c.为了验证D中发生了氧化还原反应,加入用稀盐酸
酸化的BaCl2,产生白色沉淀
d.为了验证D中FeCl3完全发生了氧化还原反应,加入KSCN溶液,无明显现象
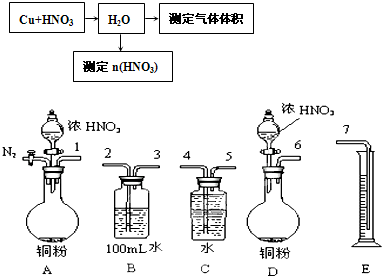
 (3)为了探究铜与稀硝酸反应产生的气体主要是NO而设计了下列实验,装置如图所示
(3)为了探究铜与稀硝酸反应产生的气体主要是NO而设计了下列实验,装置如图所示
①设计装置A的目的是:
,
此装置的明显缺陷是 。
②若将过量铜粉与一定量浓硝酸反应,当反应完全停止时,
共收集到的气体1.12L(标准状况),则该气体的主要成分是:
,反应中所消耗的硝酸的物质的量可能为
(填序号)。
A.0.1mol B.0.15mol C.0.2mol D.0.25mol
(1)Cu + H2O2 + 2H+ = Cu2+ + 2H2O(2分)
(2)①品红溶液颜色变浅或褪色(1分)
②从D向试管中通入空气(1分) ③ a(1分)
(3)①利用产生的二氧化碳气体排出B管中的氧气(1分),无尾气吸收装置(1分)。
②NO、NO2(1分,缺1种不得分) ,B(2分)

 阅读快车系列答案
阅读快车系列答案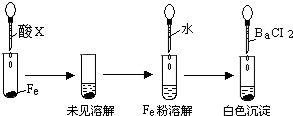 盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.现就三大酸与金属铜反应的情况,回答下列问题:
盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.现就三大酸与金属铜反应的情况,回答下列问题: