题目内容
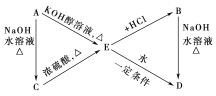
【题目】已知:R—CH=CH2+HX→![]() (主要产物)。下列转化中A、B分别是分子式为C3H7Cl的两种同分异构体,请根据转化关系和反应条件,判断并写出:
(主要产物)。下列转化中A、B分别是分子式为C3H7Cl的两种同分异构体,请根据转化关系和反应条件,判断并写出:
(1)A、B、C、D、E的结构简式____、____、____、____、____。
(2)由E转化为B、由A转化为E的化学方程式____、____。
【答案】CH3CH2CH2Cl CH3CHClCH3 CH3CH2CH2OH CH3CHOHCH3 CH3CH=CH2 CH3CH=CH2 + HCl ![]() CH3CHClCH3 CH3CH2CH2Cl + KOH
CH3CHClCH3 CH3CH2CH2Cl + KOH ![]() CH3CH=CH2↑+ KCl + H2O
CH3CH=CH2↑+ KCl + H2O
【解析】
根据信息R—CH=CH2+HX→![]() (主要产物),得出E到B就应用此信息,E为CH3CH=CH2,B为CH3CHClCH3,而A为CH3CH2CH2Cl,A到C发生水解反应,C为CH3CH2CH2OH,B到D发生水解反应,D为CH3CHOHCH3。
(主要产物),得出E到B就应用此信息,E为CH3CH=CH2,B为CH3CHClCH3,而A为CH3CH2CH2Cl,A到C发生水解反应,C为CH3CH2CH2OH,B到D发生水解反应,D为CH3CHOHCH3。
(1)根据前面分析得出A、B、C、D、E的结构简式CH3CH2CH2Cl、CH3CHClCH3、CH3CH2CH2OH、CH3CHOHCH3、CH3CH=CH2,故答案为:CH3CH2CH2Cl;CH3CHClCH3;CH3CH2CH2OH;CH3CHOHCH3;CH3CH=CH2。
(2)由E转化为B的化学方程式 CH3CH=CH2 + HCl ![]() CH3CHClCH3,由A转化为E的化学方程式CH3CH2CH2Cl + KOH
CH3CHClCH3,由A转化为E的化学方程式CH3CH2CH2Cl + KOH ![]() CH3CH=CH2 + KCl + H2O,故答案为:CH3CH=CH2 + HCl
CH3CH=CH2 + KCl + H2O,故答案为:CH3CH=CH2 + HCl ![]() CH3CHClCH3;CH3CH2CH2Cl + KOH
CH3CHClCH3;CH3CH2CH2Cl + KOH ![]() CH3CH=CH2 + KCl + H2O。
CH3CH=CH2 + KCl + H2O。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】非金属及其化合物在工农业生产、生活中有着重要应用,减少非金属的氧化物在大气中的排放是环境保护的重要内容之一。
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1
2C(s)+O2(g)=2CO(g) △H=-221kJ·mol-1
若某反应的平衡常数表达式为:K=![]() ,请写出此反应的热化学方程式___。
,请写出此反应的热化学方程式___。
(2)N2O5在一定条件下可发生分解:2N2O5(g)![]() 4NO2(g)+O2(g) △H>0。向恒容密闭容器加入N2O5。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
4NO2(g)+O2(g) △H>0。向恒容密闭容器加入N2O5。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
c(N2O5)/(mo·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.35 | 0.35 |
反应开始时体系压强为P0,第3.00min时体系压强为p1,则p1:p0=__;1.00min~3.00min内,O2的平均反应速率为__。从表中可知化学反应速率变化规律是__。
①该温度下反应的平衡常数Kp=__(用平衡分压代替平衡浓度计算,分压=总压×物质的量的分数,请列出用P0表示平衡常数表达式,不用计算)。
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是__。
a.容器中压强不再变化 b.NO2和O2的体积比保持不变
c.2v正(NO2)=v逆(N2O5) d.混合气体的密度保持不变
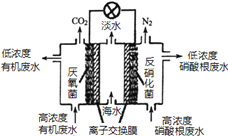
(3)“长征”火箭发射使用的燃料是偏二甲肼(C2H8N2),并使用四氧化二氮作为氧化剂,这种组合的两大优点是,既能在短时间内产生巨大能量将火箭送上太空,产物又不污染空气(产物都是空气成分)。某校外研究性学习小组拟将此原理设计为原电池,如图所示,结合学习过的电化学原理分析B极发生的电极反应式为__。