题目内容
【题目】已知反应:①25℃、101kPa时,2C(s)+O2(g)=2CO(g) ΔH=221kJ·mol-1,②稀溶液中,H+(aq)+OH(aq)=H2O(l) ΔH=57.3kJ·mol-1。下列说法正确的是( )
A.碳的燃烧热大于110.5kJ·mol-1
B.①的反应热为221kJ·mol-1
C.浓硫酸与稀NaOH溶液反应生成1mol水放出的热量为57.3kJ
D.稀醋酸与稀NaOH溶液反应生成1mol水时放出57.3kJ的热量
【答案】A
【解析】
A.由2C(s)+O2(g)=2CO(g) ΔH=221kJ·mol-1,可得出C(s)+![]() O2(g)=CO(g) ΔH=110.5kJ·mol-1,CO燃烧还会放出热量,所以碳的燃烧热大于110.5kJ·mol-1,A正确;
O2(g)=CO(g) ΔH=110.5kJ·mol-1,CO燃烧还会放出热量,所以碳的燃烧热大于110.5kJ·mol-1,A正确;
B.①的反应热为-221kJ·mol-1,B不正确;
C.浓硫酸溶于水放热,所以浓硫酸与稀NaOH溶液反应生成1mol水放热大于57.3kJ, C不正确;
D.稀醋酸电离时吸热,所以稀醋酸与稀NaOH溶液反应生成1mol水时放出小于57.3kJ的热量,D不正确;
故选A。

【题目】由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引用了各界的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),该反应的能量变化如图所示:
CH3OH(g)+H2O(g),该反应的能量变化如图所示:
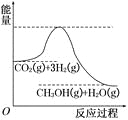
(1)上述反应平衡常数K的表达式为_______________,温度降低,平衡常数K_______(填“增大”、“不变”或“减小”)。
(2)在体积为2 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2的物质的量随时间变化如下表所示。从反应开始到5 min末,用氢气浓度变化表示的平均反应速率v(H2)=_______。
t/min | 0 | 2 | 5 | 10 | 15 |
n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
(3)下列条件能使上述反应的反应速率增大,且平衡向正反应方向移动的是_______(填写序号字母)
a.及时分离出CH3OH气体
b.适当升高温度
c.保持容器的容积不变,再充入1 mol CO2和3 mol H2
d.选择高效催化剂
【题目】![]() 使
使![]() 和
和![]() 通过灼热的炭层,生成HCl和
通过灼热的炭层,生成HCl和![]() ,当有
,当有![]() 参与反应时释放出145kJ热量,写出该反应的热化学方程式________________.
参与反应时释放出145kJ热量,写出该反应的热化学方程式________________.
![]() 火箭和导弹表面的薄层是耐高温物质
火箭和导弹表面的薄层是耐高温物质![]() 将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料
将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料![]() ,则反应过程中,每转移1mol电子放出的热量为____________.
,则反应过程中,每转移1mol电子放出的热量为____________.
![]() 甲胺
甲胺![]() 是合成太阳能敏化剂的原料。工业合成甲胺原理:
是合成太阳能敏化剂的原料。工业合成甲胺原理:![]()
![]()
![]() 。
。
![]() 已知键能指断开1mol气态键所吸收的能量或形成1mol气态键所释放的能量。几种化学键的键能如下表所示:
已知键能指断开1mol气态键所吸收的能量或形成1mol气态键所释放的能量。几种化学键的键能如下表所示:
化学键 |
|
|
|
|
|
键能 | 413 | 351 | 463 | 393 | 293 |
则该合成反应的![]() ______________。
______________。
若![]() 的活化能为
的活化能为![]() ,由此计算
,由此计算![]()
![]() 的活化能
的活化能![]() ______。
______。
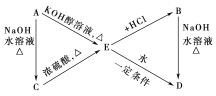
![]() 用
用![]() 将HCl转化为
将HCl转化为![]() ,可提高效益,减少污染,传统上该转化通过如图所示的催化剂循环实现,
,可提高效益,减少污染,传统上该转化通过如图所示的催化剂循环实现,
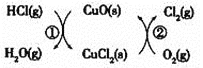
其中,反应![]() 为:
为:![]() 反应
反应![]() 生成
生成![]() 的反应热为
的反应热为![]() ,则总反应的热化学方程式为_____________,
,则总反应的热化学方程式为_____________,![]() 反应热用
反应热用![]() 和
和![]() 表示
表示![]() .
.