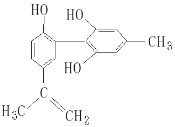
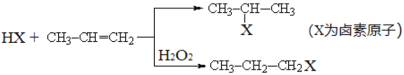
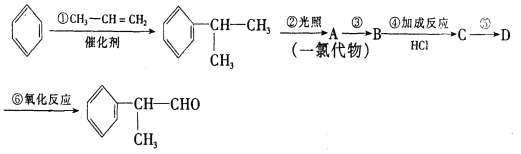
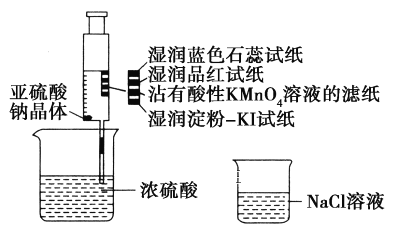
题目内容
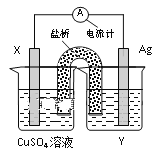
【题目】“暖冰”是韩国首尔大学科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成的.某老师在课堂上做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色.若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,则溶液呈血红色.则下列说法中不正确的是( )
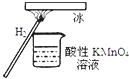
A. 在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”
B. 水凝固形成20℃时的“暖冰”所发生的变化是化学变化
C. 该条件下H2燃烧生成了既具有氧化性又具有还原性的物质
D. 该条件下H2燃烧的产物中可能含有一定量的H2O2
【答案】B
【解析】
A.在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”,否则20℃时,水分子不能瞬间凝固形成冰,选项A正确;
B.水凝固形成20℃时的“暖冰”,只是水的存在状态发生了变化,没有生产新的物质,所发生的是物理变化,选项B错误;
C.酸性KMnO4溶液褪色,说明燃烧生成了具有还原性的物质;含有少量KSCN 的FeCl2溶液呈血红色,说明燃烧生成了具有氧化性的物质,选项C正确;
D.该条件下H2燃烧生成了既具有氧化性又具有还原性的物质,该物质可能含有一定量的双氧水,选项D正确;
答案选B。

【题目】在一固定体积的密闭容器中,充入2 mol CO2和1 mol H2发生如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数与温度(T)的关系如下表:
CO(g)+H2O(g),其化学平衡常数与温度(T)的关系如下表:
T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_________________。
(2)若反应在830 ℃下达到平衡,则CO2气体的转化率为________。
(3)若绝热时(容器内外没有热量交换),平衡发生移动的结果是使容器内CO的浓度增大,则容器内气体温度________(填“升高”、“降低”或“不能确定”)。
(4)能判断该反应是否达到化学平衡状态的依据是____________。
A 容器内压强不变 B 混合气体中c(CO)不变
C v正(H2)=v逆(H2O) D c(CO2)=c(CO)
E c(CO2 )·c(H2)=c(CO)·c(H2O)
(5)当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx,可用CxHy(烃)催化还原NOx消除氮氧化物的污染。
已知:CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ·mol-1
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) △H2
CH4(g)+2NO2(g) = N2(g)+CO2(g)+2H2O(g) △H3=-867 kJ·mol-1
△H2=_____________。
【题目】工业上,常采用氧化还原方法处理尾气中的CO、NO。
方法1:氧化法。沥青混凝土可作为反应:2CO(g)+O2(g)![]() 2CO2(g)的催化剂。图甲表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
2CO2(g)的催化剂。图甲表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
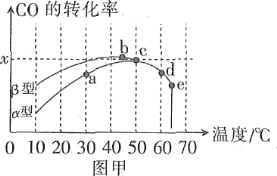
(1)在a、b、c、d四点中,未达到平衡状态的是____。
(2)已知c点时容器中O2浓度为0.04mol·L-1,则50℃时,在α型沥青混凝土中CO转化反应的平衡常数K=____(用含x的代数式表示)。
(3)下列关于图甲的说法正确的是____。
A.CO转化反应的平衡常数K(a)<K(c)
B.在均未达到平衡状态时,同温下β型沥青混凝土中CO转化速率比α型要大
C.b点时CO与O2分子之间发生有效碰撞的几率在整个实验过程中最高
D.e点转化率出现突变的原因可能是温度升高后催化剂失去活性
方法2:还原法。某含钴催化剂可以催化消除柴油车尾气中的碳烟(C)和NOx。不同温度下,将模拟尾气(成分如表所示)以相同的流速通过该催化剂,测得所有产物(CO2、N2、N2O)与NO的相关数据结果如图乙所示。
模拟尾气 | 气体(10 mol) | 碳烟 | ||
NO | O2 | He | ||
物质的量(mol) | 0.025 | 0.5 | 9.475 | n |
(4)375℃时,测得排出的气体中含0.45molO2和0.052molCO2,则Y的化学式为____。
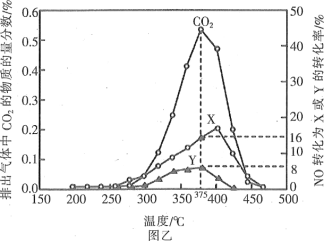
(5)实验过程中采用NO模拟NOx,而不采用NO2的原因是____。
【题目】某学生在实验室制取乙酸乙酯的主要步骤如下:①在大试管A中配制反应混合液;②按图甲所示连接装置(装置气密性良好),用小火均匀加热大试管5~10min;③待试管B收集到一定量产物后停止加热,撤去导管并用力振荡,然后静置待分层;④分离出乙酸乙酯层,洗涤、干燥。
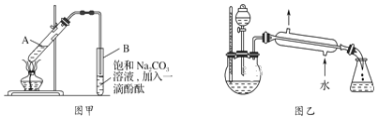
已知乙醇可以与氯化钙反应,生成微溶于水的CaCl26C2H5OH;无水硫酸钠易吸水形成硫酸钠结晶水合物。有关试剂的部分数据如下:
物质 | 熔点/℃ | 沸点/℃ | 密度/gcm﹣3 |
乙醇 | ﹣117.3 | 78.5 | 0.789 |
乙酸 | 16.6 | 117.9 | 1.05 |
乙酸乙酯 | ﹣83.6 | 77.5 | 0.90 |
浓硫酸(98%) | 338.0 | 1.84 |
(1) 请用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O在反应前后位置变化的化学方程式:_______。
(2)上述实验中饱和Na2CO3溶液的作用是_____________。
(3)写出步骤③中观察到的实验现象______。
(4)分离出乙酸乙酯层后,一般用饱和CaCl2溶液洗涤,通过洗涤可除去的杂质是_____(填名称);干燥乙酸乙酯可选用的干燥剂为下列四个选项中的_____(填字母)。
a.P2O5 b.无水硫酸钠 c.碱石灰 d.NaOH固体
(5)某化学课外小组设计了图乙所示的装置制取乙酸乙酯(图中铁架台、铁夹、加热装置均已略去),与图甲装置相比,图乙装置的主要优点有___(填字母)。
a.增加了温度计,有利于控制反应温度
b.增加了分液漏斗,能随时补充反应混合液
c.增加了冷凝装置,有利于收集产物
d.反应容器容积大,容纳反应物的量多,反应速率加快
(6)实验中加入乙酸的质量为2.1 g,最终制得1.848 g乙酸乙酯,则乙酸的转化率为_____