题目内容
【题目】某校化学兴趣小组为研究Cl2单质的性质,设计如图所示装置进行实验.装置III中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸.
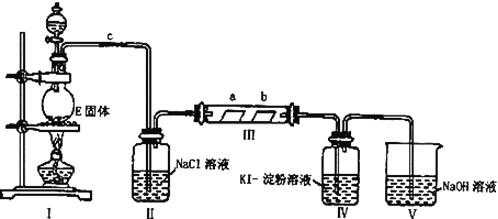
(1)实验室以二氧化锰和浓盐酸制备氯气的化学方程式是: ;
(2)加入药品前,检查Ⅰ中气体发生装置气密性的操作是: ;
(3)装置Ⅱ的作用是 ;
(4)实验过程中,装置Ⅳ中的实验现象为 ;发生反应的化学方程式为 ;
(5)实验结束后,该组同学在装置Ⅲ中观察b的红色退去,但是并未观察到“a无明显变化”这一预期现象,为了达到这一目的,你认为应在 之间还需添加洗气瓶(选填装置序号),该装置的作用是 ;
(6)装置Ⅴ的目的是防止尾气污染空气,写出装置Ⅴ中发生反应的离子方程式 .
【答案】(1)MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)用止水夹夹住C处橡皮管,然后向分液漏斗中加水,打开分液漏斗活塞,液体不能顺利流下则气密性好;
(3)除去氯气中的氯化氢气体;
(4)无色溶液变蓝色;Cl2+2KI=I2+2KCl;
(5)Ⅱ和Ⅲ;干燥Cl2;(6)Cl2+2OH﹣=Cl﹣+ClO﹣+H2O。
【解析】试题分析:(1)实验室制备氯气,利用MnO2和浓盐酸的反应,反应方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;(2)用止水夹夹住C处橡皮管,然后向分液漏斗中加水,打开分液漏斗活塞,液体不能顺利流下则气密性好;(3)因为Cl2+H2O
MnCl2+Cl2↑+2H2O;(2)用止水夹夹住C处橡皮管,然后向分液漏斗中加水,打开分液漏斗活塞,液体不能顺利流下则气密性好;(3)因为Cl2+H2O![]() H++Cl-+HClO,用饱和食盐水,增加c(Cl-),平衡向逆反应方向移动,抑制氯气的溶解,但HCl易溶于水,因此装置II的作用是除去氯气中的氯化氢气体;(4)发生Cl2+2I-=2Cl-+I2,淀粉遇碘单质变蓝,出现的现象是无色溶液变蓝;(5)从II中出来的氯气含有水蒸气,使a品红试纸褪色,应在)Ⅱ和Ⅲ加一个盛有浓硫酸的洗气瓶,除去氯气中水蒸气;(6)氯气有毒,装置V的作用是尾气处理,因此离子反应方程式为:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O。
H++Cl-+HClO,用饱和食盐水,增加c(Cl-),平衡向逆反应方向移动,抑制氯气的溶解,但HCl易溶于水,因此装置II的作用是除去氯气中的氯化氢气体;(4)发生Cl2+2I-=2Cl-+I2,淀粉遇碘单质变蓝,出现的现象是无色溶液变蓝;(5)从II中出来的氯气含有水蒸气,使a品红试纸褪色,应在)Ⅱ和Ⅲ加一个盛有浓硫酸的洗气瓶,除去氯气中水蒸气;(6)氯气有毒,装置V的作用是尾气处理,因此离子反应方程式为:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】实验室中有一未知浓度的稀盐酸,某学生用0.10 mol·L-1 NaOH标准溶液进行测定盐酸的浓度的实验。取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。请完成下列填空:

实验编号 | 待测盐酸的体积(mL) | NaOH溶液的浓度(mol·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) |
1 | 20.00 | 0.10 | 24.18 |
2 | 20.00 | 0.10 | 23.06 |
3 | 20.00 | 0.10 | 22.96 |
I、(1)滴定达到终点的标志是是 。
(2)根据上述数据,可计算出该盐酸的浓度约为 (保留小数点后2位)。
(3)排除碱式滴定管尖嘴中气泡的方法应采用 操作,然后轻轻挤压玻 璃球使尖嘴部分充满碱液。(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 。
A.用酸式滴定管取20.00 mL待测盐酸,使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥
C.称量NaOH固体时,有小部分NaOH潮解
D.滴定终点读数时俯视
E.碱式滴定管尖嘴部分有气泡,滴定后消失
II、硼酸(H3BO3)是生产其它硼化物的基本原料。已知H3BO3的电离常数为5.8×10-10,H2CO3的电离常数为K1=4.4×10-7、K2=4.7×10-11。向盛有饱和硼酸溶液的试管中,滴加0.1 mol/LNa2CO3溶液, (填“能”或“不能”)观察到气泡逸出。已知H3BO3与足量NaOH溶液反应的离子方程式为H3BO3+OH-=B(OH)4-,写出硼酸在水溶液中的电离方程式 。
Ⅲ、某温度时,测得0.01 mol/L的NaOH溶液pH为11,求该温度下水的离子积常数Kw
【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
ⅠA | 0 | |||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
4 | ⑨ | ⑩ | ||||||
(1)金属性最强的元素是___________(填元素名称);⑥的离子结构示意图是________________ ;
(2)④、⑤、⑥的原子半径由大到小的顺序为_________________。 (填元素符号);
(3)②、③、⑧的最高价含氧酸的酸性由强到弱的顺序是________________。
(4)少量元素⑤的单质通常保存在_______________中;
(5)用电子式表示④和⑤形成化合物的过程: ___________________
(6)常温下,将元素⑧的单质通入元素⑤的最高价氧化物对应的水化物中,其反应的离子方程式为___________________。
(7)在⑧与⑩的单质中,化学性质较活泼的是____________________,(填元素符号)
请设计一个实验方案,证明⑧和⑩的非金属性强弱___________________。
