题目内容
【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
ⅠA | 0 | |||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
4 | ⑨ | ⑩ | ||||||
(1)金属性最强的元素是___________(填元素名称);⑥的离子结构示意图是________________ ;
(2)④、⑤、⑥的原子半径由大到小的顺序为_________________。 (填元素符号);
(3)②、③、⑧的最高价含氧酸的酸性由强到弱的顺序是________________。
(4)少量元素⑤的单质通常保存在_______________中;
(5)用电子式表示④和⑤形成化合物的过程: ___________________
(6)常温下,将元素⑧的单质通入元素⑤的最高价氧化物对应的水化物中,其反应的离子方程式为___________________。
(7)在⑧与⑩的单质中,化学性质较活泼的是____________________,(填元素符号)
请设计一个实验方案,证明⑧和⑩的非金属性强弱___________________。
【答案】 钾 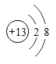 Na>Al>O HClO4> HNO3> H2CO3 煤油
Na>Al>O HClO4> HNO3> H2CO3 煤油 ![]() Cl2+2OH-=Cl-+ClO-+H2O Cl2 将氯水加入溴化钠溶液中,有红棕色的Br2生成,证明单质氯比单质溴氧化性强
Cl2+2OH-=Cl-+ClO-+H2O Cl2 将氯水加入溴化钠溶液中,有红棕色的Br2生成,证明单质氯比单质溴氧化性强
【解析】本题考查元素周期表和元素周期律的应用,(1)同主族从上到下金属性增强,同周期从左向右金属性减弱,即金属性最强的是K,即钾;⑥为Al,其离子为Al3+,离子结构示意图为: ;(2)半径大小比较:一看电子层数,电子层数越多,半径越大,二看原子序数,电子层数相同,半径随着原子序数的增加而减小,即Na>Al>O;(3)⑧的最高价氧化物对应水化物是HClO4,HClO4酸性最强,②C的最高价氧化物对应水化物是H2CO3,属于弱酸,③的最高价氧化物对应水化物是HNO3,属于强酸,因此酸性强弱:HClO4.HNO3>H2CO3;(4)⑤为金属钠,少量的金属钠保存在煤油中;(5)④和⑤形成的化合物是Na2O和Na2O2,
;(2)半径大小比较:一看电子层数,电子层数越多,半径越大,二看原子序数,电子层数相同,半径随着原子序数的增加而减小,即Na>Al>O;(3)⑧的最高价氧化物对应水化物是HClO4,HClO4酸性最强,②C的最高价氧化物对应水化物是H2CO3,属于弱酸,③的最高价氧化物对应水化物是HNO3,属于强酸,因此酸性强弱:HClO4.HNO3>H2CO3;(4)⑤为金属钠,少量的金属钠保存在煤油中;(5)④和⑤形成的化合物是Na2O和Na2O2,![]() ;(6)⑧是氯元素,其单质为氯气,⑤的最高价氧化物对应水化物是NaOH,离子反应是Cl2+2OH-=Cl-+ClO-+H2O;(7)⑧是Cl,⑩是Br,同主族从上到下非金属性减弱,因此氯气的氧化性强于溴单质,利用置换反应,氧化剂的氧化性强于氧化产物的氧化性,将氯水加入溴化钠溶液中,有红棕色的Br2生成,证明单质氯比单质溴氧化性强。
;(6)⑧是氯元素,其单质为氯气,⑤的最高价氧化物对应水化物是NaOH,离子反应是Cl2+2OH-=Cl-+ClO-+H2O;(7)⑧是Cl,⑩是Br,同主族从上到下非金属性减弱,因此氯气的氧化性强于溴单质,利用置换反应,氧化剂的氧化性强于氧化产物的氧化性,将氯水加入溴化钠溶液中,有红棕色的Br2生成,证明单质氯比单质溴氧化性强。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】常温下,下列各组物质中,Y既能与X反应又能与Z反应的是
X | Y | Z | |
① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
② | KOH溶液液 | Na2CO3 | 稀盐酸 |
③ | CO2 | Na2O2 | H2O |
④ | FeCl3溶液 | Cu | 稀硫酸 |
A. ①③ B. ①④ C. ②④ D. ②③


