题目内容
14. 天然气在生产、生活中具有广泛的应用.
天然气在生产、生活中具有广泛的应用.(1)CO2(g)+4H2(g)?CH4(g)+2H2O(g)△H=-162kJ•mol-1.其他条件相同,实验测得在T1和Pl与T2和P2条件下该反应的H2平衡转化率相同,若T1>T2、则Pl>P2 (填“>”“<”或“=”),平衡常数K1<K2(填“>”“<”或“=”).
(2)另一合成CH4的原理:CO(g)+3H2(g)?CH4(g)+H2O(g).某温度时将0.1molCO和0.3mol H2充入10L的密闭容器内,l0min时达平衡.测得10min内v(CO)=0.0009mol•L-1•min-1,则H2的平衡转化率为90%,该温度下反应的平衡常数为3×106mol-2•L2.
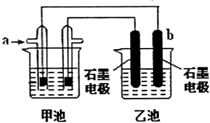
(3)某实验小组依据甲烷燃烧的反应原理,设计如图所示的装置.已知甲池的总反应式为 CH4+2O2+2KOH=K2CO3+3H2O,乙池中盛有1L lmo1•L-1CuSO4溶液.a电极通入的气体为CH4,其电极反应式是CH4-8e-+10OH-═7H2O+CO32-,b电极的现象为有红色的物质析出.一段时间内乙池中溶液的pH由2变为1,则在这段时间内转移电子的物质的量为0.09mol.
分析 (1)根据CO2(g)+4H2(g)?CH4(g)+2H2O(g)△H=-162kJ•mol-1,则该反应为气体体积减小的放热反应,所以升温向逆反应方向进行,而加压则向正反应方向进行,平衡常数仅与温度有关,据此分析;
(2)根据10min内v(CO)=0.0009mol•L-1•min-1计算反应消耗的CO的物质的量,再利用三段式,结合转化率=$\frac{转化量}{起始量}$计算一氧化碳的转化率,K=$\frac{c(CH{\;}_{4})c(H{\;}_{2}O)}{c(CO)c(H{\;}_{2}){\;}^{3}}$进行计算平衡常数;
(3)甲池能自发的进行氧化还原反应,为原电池,a电极通入的气体为CH4是负极,电极反应式为CH4-8e-+10OH-═7H2O+CO32-,正极上氧气得电子发生还原反应,电极反应式为O2+2H2O+4e-=4OH-;乙池为电解池,与a电极相连的b电极是阴极,阴极上铜离子放电析出铜单质,乙池中阳极上氢氧根离子放电,根据转移电子相等计算转移电子的物质的量.
解答 解:(1)因为CO2(g)+4H2(g)?CH4(g)+2H2O(g)△H=-162kJ•mol-1,则该反应为气体体积减小的放热反应,所以升温向逆反应方向进行,加压则向正反应方向进行,而实验测得在T1和Pl与T2和P2条件下该反应的H2平衡转化率相同,若T1>T2,所以Pl>P2;
又平衡常数仅与温度有关,升温又向逆反应方向进行,所以温度高平衡常数反而小,则平衡常数K1 <K2;故答案为:>;<;
(2)因为10min内v(CO)=0.0009mol•L-1•min-1,所以10min内消耗CO的物质的量为0.0009mol•L-1•min-1×10L×10min=0.09mol,
则有 CO(g)+3H2(g)?CH4(g)+H2O(g)
开始0.1mol 0.3mol 0 0
转化0.09mol 0.27mol 0.09mol 0.09mol
平衡0.01mol 0.03mol 0.09mol 0.09mol
所以CO的转化率=$\frac{转化量}{起始量}$×100%=$\frac{0.09}{0.1}$×100%=90%;
K=$\frac{c(CH{\;}_{4})c(H{\;}_{2}O)}{c(CO)c(H{\;}_{2}){\;}^{3}}$=$\frac{\frac{0.09}{10}×\frac{0.09}{10}}{\frac{0.01}{10}×(\frac{0.03}{10}){\;}^{3}}$=3×106;故答案为:90%;3×106;
(3)甲池能自发的进行氧化还原反应,为原电池,a电极通入的气体为CH4是负极,电极反应式为CH4-8e-+10OH-═7H2O+CO32-,乙池为电解池,与a电极相连的b电极是阴极,阴极上铜离子放电析出铜单质,现象为有红色的物质析出;
一段时间内乙池中溶液的pH由2变为1,则氢离子浓度增加0.1mol/L-0.01mol/L=0.09mol/L,所以增加氢离子物质的量为0.09mol/L×1L=0.09mol,则阳极消耗氢氧根物质的量为0.09mol,则根据乙池中阳极上氢氧根离子放电生成氧气,反应式为4OH--4e-=O2↑+2H2O,所以这段时间内转移电子的物质的量为0.09mol;
故答案为:CH4-8e-+10OH-═7H2O+CO32-;有红色的物质析出;0.09.
点评 本题考查了化学平衡移动原理分析,平衡计算以及原电池和电解池原理,正确判断原电池和电解池是解本题关键,再结合各个电极上发生的反应来分析解答,难点是电极反应式的书写,题目难度中等.

| A. | 丙烷分子的球棍模型是 | B. | 2-氯甲苯的结构简式: | ||
| C. | 乙醛分子的结构简式是CH3COH | D. | 葡萄糖、淀粉的最简式都是CH2O |
某研究性学习小组为测定氨水的浓度,并用氨水作提纯胆矾时的试剂,根据所查阅资料设计实验如下:
查阅资料:
①甲基橙的变色范围:pH<3.1红色,pH=3.1~4.4橙色,pH>4.4黄色
②酚酞的变色范围:pH<8.2无色,pH=8.2~10.0粉红色,pH>10.0红色
③已知:Fe3+、Fe2+、Cu2+转化为氢氧化物时相应的pH如下表1:
| Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | |
| 开始沉淀时的pH | 2.7 | 7.6 | 5.2 |
| 完全沉淀时的pH | 3.7 | 9.6 | 6.4 |
| 表1 | |||
| 编号 | 1 | 2 | 3 | 4 | |
| 盐酸体积/mL | 25.05 | 25.00 | 26.80 | 24.95 | |
实验一 标定氨水的浓度
取25.00mL约为0.10mol•L-1氨水于锥形瓶中,用0.1000mol•L-1盐酸进行滴定,实验所得数据如上表2所示:
(1)滴定产物水解的离子方程式为NH4Cl+H2O?NH3.H2O+HCl,由此可推知选择的滴定指示剂应为甲基橙.(填“甲基橙”或“酚酞”)
(2)该氨水的准确浓度为0.1000mol•L-1.(精确到小数点后四位)
(3)编号3中溶液的离子浓度由大到小的顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-).
实验二 提纯胆矾晶体
某学习小组同学拟从含FeSO4、Fe2(SO4)3杂质的CuSO4溶液中提纯胆矾,其主要实验步骤如下:
第一步 往混合液中加入3% H2O2溶液充分反应后,再加入稀氨水调节溶液pH,过滤.
第二步 往滤液中加入稀硫酸调节溶液pH 至1~2,提纯胆矾.
(4)加入3% H2O2溶液的作用是将Fe 2+氧化为Fe 3+.
(5)加稀氨水调节pH应调至范围3.7-5.2之间.
(6)下列物质可用来替代稀氨水的是BC.(填字母)
A.NaOH B.Cu(OH)2 C.CuO D.NaHCO3.
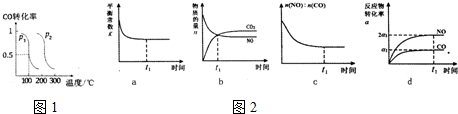
(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol相关数据如下
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2(g)和3molH2(g) | 1molCH3OH和1molH2O(g) |
| 平衡时c(CH3OH) | c1 | c2 |
| 平衡时能量变化 | 放出29.4kJ | 吸收akJ |
②若甲中反应10s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是0.03mol)L.s)
(2)压强为p1时,向体积为1L密闭容器中充入bmolCO和2bmolH2,发生反应CO(g)+2H2(g)?CH3OH(g)
,平衡时CO的转化率与温度、压强的关系如图1所示,请回答:
①该反应属于放(填“吸”或“放”)热反应,p1<p2(填“>”“<”或“=”)
②100℃时,该反应的平衡常数K=$\frac{1}{{b}^{2}}$(用含b的代数式表示)
(3)治理汽车尾气的反应是2NO(g)+2CO(g)?2CO2+N2(g)在常温下能够自发进行,则它的△H<0.(填>、<).在恒温容的密闭容器中通入n(NO):n(CO)=1:2的混合气体,发生上述反应,下列图象说明反应在进行到t1时刻一定达到平衡状态的是cd(选填字母)
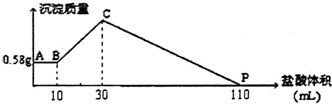 把由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水中,有0.58g白色沉淀析出,向所得的浑浊液中,逐渐加入1mol/L盐酸,加入盐酸的体积与生成沉淀的质量关系如图所示.则混合物中NaOH质量为( )
把由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水中,有0.58g白色沉淀析出,向所得的浑浊液中,逐渐加入1mol/L盐酸,加入盐酸的体积与生成沉淀的质量关系如图所示.则混合物中NaOH质量为( )| A. | 3.6g | B. | 4g | C. | 4.4g | D. | 4.8g |
| A. | 分馏 | B. | 热裂化 | C. | 裂解 | D. | 催化裂化 |
| A. | 乙醇 | B. | 乙烯 | C. | 乙酸 | D. | 碳酸钠溶液 |