题目内容
【题目】(1)在2L的密闭容器中放入4molN2O5,发生如下反应:2N2O5(g)![]() 4NO2(g)+O2(g)。反应至5min时,测得N2O5转化了20%,则v(NO2)为___,c(N2O5)为___,O2的物质的量浓度为___。
4NO2(g)+O2(g)。反应至5min时,测得N2O5转化了20%,则v(NO2)为___,c(N2O5)为___,O2的物质的量浓度为___。
(2)某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。根据图中数据填空:

①该反应的化学方程式为___。
②反应至平衡时,v(X)为___,c(Z)为___。
③若X、Y、Z均为气体,则达平衡时,容器内混合气体的平均相对分子质量比起始投料时___(填“增大”“减小”或“相等”)。
【答案】0.16mol·L-1·min-1 1.6mol·L-1 0.2mol·L-1 3X+Y![]() 2Z 0.375mol·L-1 0.1mol·L-1 增大
2Z 0.375mol·L-1 0.1mol·L-1 增大
【解析】
(1)在2L的密闭容器中放入4molN2O5,发生如下反应:2N2O5(g)![]() 4NO2(g)+O2(g)。反应至5min时,测得N2O5转化了20%,则参加反应的五氧化二氮的物质的量=4mol×20%=0.8mol,则:
4NO2(g)+O2(g)。反应至5min时,测得N2O5转化了20%,则参加反应的五氧化二氮的物质的量=4mol×20%=0.8mol,则:
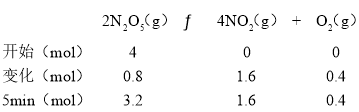
υ(NO2)=![]() =0.16mol·L-1·min-1 ;
=0.16mol·L-1·min-1 ;
c(N2O5)=![]() =1.6mol·L-1 ;
=1.6mol·L-1 ;
c(O2)=![]() =0.2mol·L-1 ;
=0.2mol·L-1 ;
故答案为:0.16mol·L-1·min-1 ; 1.6mol·L-1 ; 0.2mol·L-1;
(2)某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。根据图中数据填空:
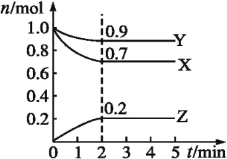
①X、Y的物质的量减小,为反应物,Z的物质的量增大为生成物,最终X、Y的物质的量不变,且不为0,属于可逆反应,X、Y、Z的化学计量数之比=(1-0.7):(1-0.9):0.2=3:1:2,故反应方程式为3X+Y![]() 2Z。故答案为:3X+Y
2Z。故答案为:3X+Y![]() 2Z;
2Z;
②反应至平衡时,v(X)=![]() =0.375mol·L-1,c(Z)=
=0.375mol·L-1,c(Z)=![]() =0.1mol·L-1。故答案为:0.375mol·L-1;0.1mol·L-1;
=0.1mol·L-1。故答案为:0.375mol·L-1;0.1mol·L-1;
③若X、Y、Z均为气体,则达平衡时,混合气体总的质量不变,随反应进行,混合气体总的物质的量减小,结合M=![]() 可知,容器内混合气体的平均相对分子质量比起始投料时增大。故答案为:增大。
可知,容器内混合气体的平均相对分子质量比起始投料时增大。故答案为:增大。

 名校课堂系列答案
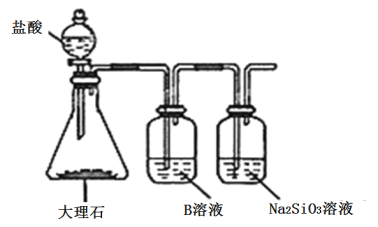
名校课堂系列答案【题目】利用图示装置进行实验,反应进行足够长时间后装置II中实验现象正确的是
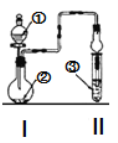
① | ② | ③ | II中实验现象 | |
A | 浓盐酸 | 大理石 | 氯化钡溶液 | 产生大量白色沉淀 |
B | 浓氨水 | 碱石灰 | 硫酸亚铁溶液 | 产生大量白色沉淀 |
C | 冰醋酸 | 乙醇和浓硫酸 | 饱和碳酸钠溶液 | 溶液分层,上层为油状液体 |
D | 浓盐酸 | KMnO4 | 氢硫酸 | 产生淡黄色沉淀 |
A.AB.BC.CD.D
【题目】下表标出的是元素周期表的一部分元素,回答下列问题:
A | B | C | |||||||||||||||
D | E | F | G | H | I | J | K | ||||||||||
M |
(1)除稀有气体外第三周期中原子半径最小的是_____(填元素符号)
(2)表中用字母标出的12种元素中,化学性质最不活泼的是_____(用元素符号表示,下同),金属性最强的是___(用元素符号表示),属于过渡元素的是___(该空格用表中的字母表示)
(3)以A的最简单氢化物为燃料,D的最高价氧化物对应水化物为电解质溶液的燃料电池,其负极电极反应式为_____
(4)D、F元素最高价氧化物对应水化物相互反应的离子方程式为_____________
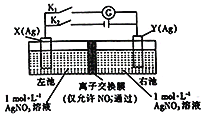
(5)为比较元素A和G的非金属性强弱,用图所示装置进行实验(夹持仪器已略去,装置气密性良好)。溶液B应该选用_____溶液,作用是_________,能说明A和G非金属性强弱的化学方程式是:______________。