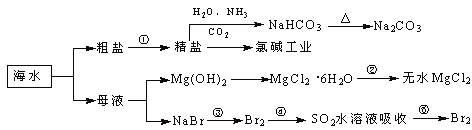
��Ŀ����
����Ŀ����ҵ�����÷�����������Ҫ�ɷ�ΪNi��������һ������Zn��Fe��SiO2��CaO���Ʊ����������壨NiC2O4��2H2O�����������£�
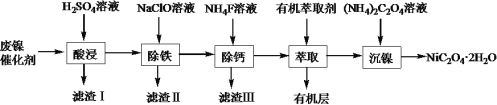
��1��NiC2O4��2H2O��C�Ļ��ϼ���______�����ܼӿ����������Ӧ������������������ԭ�������ʵIJ�����ʩΪ_____________��
��2����������������Ҫ�ɷ���_____________���������¶�Ϊ80����pH=2ʱ���������������ġ�������������Ҫ�ɷ�Ϊ����������Na2Fe6(SO4)4(OH)12����д�����ɻ����������������ӷ���ʽ��__________________��
��3����֪����������Ҫ�ɷ�ΪCaF2������ȡ�������м����л���ȡ����������__________��
��4���ڸ��������������£�����������ˮNiC2O4�õ�Ni2O3�����ֺ�̼Ԫ�ص����壬�÷�Ӧ�Ļ�ѧ����ʽ��_________��
��5����������ӵ�ص��ܷ�ӦΪ2Li + FeS = Fe + Li2S���øõ������Դ��⺬�����Է�ˮ����Ni��װ����ͼ��ͼ��X��YΪ�缫��LiPF6��SO(CH3)2Ϊ����ʣ���
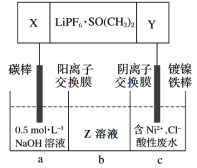
�ٵ缫X�ķ�Ӧ������_________���ѧʽ�����м����b���Եõ�����Ҫ����Z��_________���ѧʽ����
�ڵ���ܷ�Ӧ�����ӷ���ʽΪ_________����֪F��96500C/mol������ع���t min��ά�ֵ���ǿ��ΪI A�����ۻ���Ni_________g��д���������ʽ���ɣ���
���𰸡�+3 ��������Ũ�� SiO2��CaSO4 6Fe2��3ClO��2Na����4SO42��9H2O=Na2Fe6(SO4)4(OH)12����3Cl����6H�� ��ȥ��Һ�е�Zn2�� 2NiC2O4![]() Ni2O3+3CO��+CO2�� FeS NaCl 4OH-+2Ni2+
Ni2O3+3CO��+CO2�� FeS NaCl 4OH-+2Ni2+![]() O2��+2Ni+2H2O
O2��+2Ni+2H2O ![]()
��������
��������(��Ҫ�ɷ�ΪNi��������һ������Zn��Fe��SiO2��CaO��)���������ܽ⣬SiO2�������ᷴӦ�����˵õ���Һ�к���NiSO4��FeSO4��ZnSO4��CaSO4�����������ᣬ����IΪSiO2��CaSO4�����Һ�м���������ƣ���Fe2+����ΪFe3+��ͬʱ����pH��ʹFe3+ת��ΪFe(OH)3��������������IIΪ��Ԫ�صij�������Һ�к���NiSO4��CaSO4������Һ�м���NH4F����ȥCa2+�����ˣ��ټ��л���ȡ����ȥ��Һ�е�Zn2+��������Һ�м���(NH4)2C2O4���õ��������������ٹ��ˡ�ϴ�ӡ�����ò��������壬�ݴ˷�����
��1��NiC2O4��2H2O����Ϊ+2�ۣ���Ϊ-2�ۣ�HΪ+1�ۣ����ݻ������и�Ԫ�ػ��ϼ۴�����Ϊ0��֪��C�Ļ��ϼ���+3�ۣ�����Ӱ�컯ѧ��Ӧ���ʵ����ؿ�֪����߽����ʣ��ɰѷ�������������ʵ����ȡ��ʵ���������Ũ�ȡ�����ȣ�
��2������I�ijɷ���CaSO4��SiO2���������¶�80�桢pH=2���ɵõ���������[Na2Fe6(SO4)4(OH)12]����������������ԭ��Ӧ����д�����ɻ������Ƶ����ӷ���ʽΪ��2Na++3ClO-+6Fe2++4SO42-+9H2O=Na2Fe6(SO4)4(OH)12��+3Cl-+6H+��
��3����������ͼ��֪����������������Ҫ�ɷ�ΪCaF2��������ȡ�������м����л���ȡ���������dz�ȥ��Һ�е�Zn2����
��4���ڸ��������������£�����������ˮNiC2O4�õ�Ni2O3�����ֺ�̼Ԫ�ص����壬����Ϊһ����̼�Ͷ�����̼���ʷ�Ӧ�Ļ�ѧ����ʽ��2NiC2O4![]() Ni2O3+3CO��+CO2����
Ni2O3+3CO��+CO2����
��5���ٵ�⺬�����Է�ˮ����Ni������ͼ��c��Ϊ��ˮ����ӦΪNi2++2e-=Ni��������ԭ��Ӧ����Ϊ���ص����������ӵ�Դ�ĸ�����YΪ��Դ�ĸ�����XΪ��Դ���������缫X�ķ�Ӧ������FeS��c����Ni2+�õ��Ӳ���Ni�����������������ӽ���Ĥ����c�أ�a��������������ʧ���Ӳ����������������������ӽ���Ĥ����b�أ����м����b���Եõ�����Ҫ����Z��NaCl��
�ڵ�������缫��ӦʽΪNi2++2e-=Ni�������缫��ӦʽΪ4OH--4e-![]() O2��+2H2O���ʵ���ܷ�Ӧ�����ӷ���ʽΪ4OH-+2Ni2+
O2��+2H2O���ʵ���ܷ�Ӧ�����ӷ���ʽΪ4OH-+2Ni2+![]() O2��+2Ni+2H2O��
O2��+2Ni+2H2O��
��֪F��96500C/mol������ع���t min��ά�ֵ���ǿ��ΪI A�����ۻ���Ni ![]() g��
g��