题目内容
13.用Zn、Cu电极和CuSO4 溶液组成的原电池电解饱和AgNO3溶液,已知过了一段时间后,Cu电极质量增加了3mg,一段时间电解时通过的电流恒为I,时间为t,电子的电量为e,则阿伏加德罗常数的表达式为$\frac{32000It}{3e}$mol-1,这段时间里电解池的阳极产生气体的体积为0.525mL(换算成标准状况下)分析 原电池中,Cu电极为正极,正极电极反应式为:Cu2++2e-=Cu,电解池中,阳极发生氧化反应,阳极电极反应式为:4OH--4e-=2H2O+O2↑,根据电子转移守恒,结合电极反应式计算解答.
解答 解:通过的电流恒为I,时间为t,电子的电量为e,则转移电子数目为$\frac{It}{e}$,
原电池中,Cu电极为正极,正极电极反应式为:Cu2++2e-=Cu,Cu电极质量增加了3mg,即析出Cu的质量为3mg,则:$\frac{3×1{0}^{-3}g}{64g/mol}$×2×NA=$\frac{It}{e}$,故NA=$\frac{32000It}{3e}$mol-1;
电解池中,阳极发生氧化反应,阳极电极反应式为:4OH--4e-=2H2O+O2↑,则n(O2)=$\frac{3×1{0}^{-3}g}{64g/mol}$×2×$\frac{1}{4}$,故V(O2)=$\frac{3×1{0}^{-3}g}{64g/mol}$×2×$\frac{1}{4}$×22.4L/mol=0.525×10-3L=0.525mL,
故答案为:$\frac{32000It}{3e}$mol-1;0.525mL.
点评 本题考查原电池、电解池的有关计算,明确发生的反应是解题关键,注意利用电子注意守恒解答.

练习册系列答案
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
3.下列解释实验事实的离子方程式正确的是( )
| A. | 用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-═Ag++NO↑+H2O | |
| B. | 漂白粉溶液中通入过量的SO2:ClO-+SO2+H2O═HClO+HSO3- | |
| C. | 酸性KI淀粉溶液久置后变蓝:4I-+O2+4H+═2I2+2H2O | |
| D. | Na2S溶液使酚酞试液变红:S2-+2H2O?2OH-+H2S |
4.用下列实验装置进行的实验中,不能达到相应实验目的是( )
| A. | 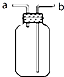 装置甲:气体从b口进入,收集Cl2 | |
| B. | 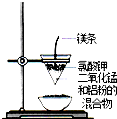 装置乙:可制得金属锰 | |
| C. | 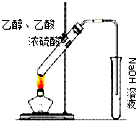 装置丙:实验室制取乙酸乙酯 | |
| D. | 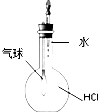 装置丁:验证HCl气体在水中的溶解性 |
1.下列属于放热反应的是( )
| A. | 2Na+2H2O═2NaOH+H2↑ | |
| B. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | |
| C. | C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2 | |
| D. | 2NH4Cl+Ba(OH)2•8H2O═BaCl2+2NH3↑+10H2O |
8.下列关于化学用语的理解正确的是( )
| A. | 比例模型 表示甲烷分子或四氯化碳分子 表示甲烷分子或四氯化碳分子 | |
| B. | 乙醛的结构简式为CH3CH2OH | |
| C. | Cl-离子的结构示意图: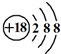 | |
| D. | “84消毒液”中有效成分NaClO的电子式为: |
5.下列物质中,能与金属钠反应放出氢气,还能与碳酸氢钠溶液反应放出二氧化碳气体的是( )
| A. | 乙醇 | B. | 苯酚 | C. | 乙醛 | D. | 乙酸 |
12.与SiO2晶体中所含化学键类型完全相同的物质是( )
| A. | Na2S | B. | P4 | C. | NaOH | D. | He |
9.已知冰的熔化热为6.0kJ/mol,冰中氢键键能为20kJ/mol;假设1mol冰中有2mol 氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中氢键的( )
| A. | 15% | B. | 30% | C. | 60% | D. | 75% |
10.硒有两种同素异形体:灰硒和红硒.灰硒溶于三氯甲烷,红硒溶于二硫化碳,它们都不溶于水,则灰硒和红硒的晶体属于( )
| A. | 原子晶体 | B. | 分子晶体 | C. | 金属晶体 | D. | 以上均有可能 |