题目内容
9.已知冰的熔化热为6.0kJ/mol,冰中氢键键能为20kJ/mol;假设1mol冰中有2mol 氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中氢键的( )| A. | 15% | B. | 30% | C. | 60% | D. | 75% |
分析 冰是由水分子通过氢键形成的分子晶体,冰的熔化热为6.0kJ•mol-1,1mol冰变成0℃的液态水所需吸收的热量为6.0kJ,全用于打破冰的氢键,冰中氢键键能为20.0kJ•mol-1,1mol冰中含有2mol氢键,需吸收40.0kJ的热量,由此分析解答.
解答 解:冰是由水分子通过氢键形成的分子晶体,冰的熔化热为6.0kJ•mol-1,1mol冰变成0℃的液态水所需吸收的热量为6.0kJ,全用于打破冰的氢键,冰中氢键键能为20.0kJ•mol-1,1mol冰中含有2mol氢键,需吸收40.0kJ的热量,$\frac{6.0kJ}{40.0kJ}$×100%=15%.由计算可知,最多只能打破1mol冰中全部氢键的15%,故选A.
点评 本题是一道侧重考查化学基本理论知识的考查,涉及氢键、熔化热等知识.做题时要正确理解这些概念的内涵.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.下列做法中,不利于环境保护的是( )
| A. | 燃煤脱硫,防止酸雨 | |
| B. | 使用无磷洗衣粉,防止水体污染 | |
| C. | 提倡使用含铅汽油,提高汽油的抗爆性 | |
| D. | 为燃料提供适当过量的空气,使燃料充分燃烧 |
17.2甲基丙烷的二氯代产物有 种(不考虑立体异构) ( )
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
4.下列说法中正确的是( )
| A. | O2与O3互为同位素 | |
| B. | ${\;}_{8}^{16}$O、${\;}_{8}^{17}$O、${\;}_{8}^{18}$O互为同素异形体 | |
| C. | 麦芽糖与蔗糖互为同分异构体 | |
| D. | CH3-CH2-CH2-CH3与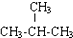 互为同系物 互为同系物 |
1.在元素周期表中,从左到右共有18个纵行.第1纵行(氢除外)为碱金属元素,稀有气体是第18纵行.下列说法中正确的是( )
| A. | 铝元素位于第3纵行,第ⅢA族 | |
| B. | 过渡元素在周期表中共占10个纵行,其中第Ⅷ族占8、9、10三个纵行 | |
| C. | 第17纵行都是非金属元素,所有元素的化合价都有+7价 | |
| D. | 第16纵行元素都是非金属元素 |
19.除去下列有机物中的少量杂质,所用试剂和分离方法均正确的是( )
| A. | 乙醇中的水:CaO,蒸馏 | B. | 乙酸乙酯中的乙酸:NaOH溶液,分液 | ||
| C. | 乙醇中的苯酚:溴水,过滤 | D. | 乙烷中的乙烯:溴水,分液 |


 .
. .
. +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$ +NaCl+H2O.
+NaCl+H2O. +(2n-1)H2O.
+(2n-1)H2O. (写出其中一种结构简式).
(写出其中一种结构简式). )的合成路线示意图.
)的合成路线示意图.