题目内容
【题目】三草酸合铁酸钾K3[Fe(C2O4)3]xH2O晶体是一种亮绿色的晶体,是制备负载型活性铁催化剂的主要原料,也是一种有机反应良好的催化剂。已知M(K3[Fe(C2O4)3])=437g/mol。本实验以(NH4)2Fe(SO4)26H2O(硫酸亚铁铵晶体)为原料,加入草酸(H2C2O4)制得草酸亚铁(FeC2O4)后,在过量的草酸根(C2O42-)部分实验过程如下:
![]()
(1)在沉淀A中加入饱和K2C2O4溶液,并用40℃左右水浴加热,再向其中慢慢滴加足量的30%H2O2溶液,不断搅拌。此过程需保持温度在40℃左右,可能的原因是:______
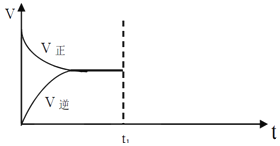
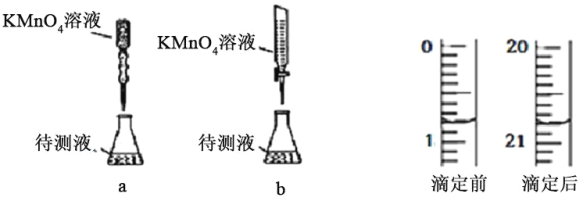
(2)某兴趣小组为知道晶体中x的数值,称取1.637g纯三草酸合铁酸钾(K3[Fe(C2O4)3]xH2O)晶体配成 100ml 溶液,取25.00mL待测液放入锥形瓶中,再加入适量的稀H2SO4,用浓度为 0.05000molL-1的KMnO4标准溶液进行滴定。其中,最合理的是______(选填 a、b)。由如图KMnO4滴定前后数据,可求得x=______。
【答案】适当提高温度以加快反应速率,若温度太高则H2O2分解 b 3
【解析】
由制备流程可知,硫酸亚铁加入稀硫酸抑制Fe2+水解,然后与草酸发生(NH4)2Fe(SO4)2·6H2O+H2C2O4═FeC2O4↓+(NH4)2SO4+H2SO4+6H2O,用过氧化氢将草酸亚铁氧化为K3[Fe(C2O4)3],发生2FeC2O4+H2O2+3K2C2O4+H2C2O4═2K3[Fe(C2O4)3]↓+2H2O,溶液C含K3[Fe(C2O4)3],蒸发浓缩、冷却结晶得到晶体。
(1)在沉淀A中加入饱和K2C2O4溶液,并用40℃左右水浴加热,再向其中慢慢滴加足量的30%H2O2溶液,不断搅拌,此过程需保持温度在40℃左右,可能的原因是适当提高温度以加快反应速率,若温度太高则H2O2分解;
(2)KMnO4标准溶液具有强氧化性,可氧化橡胶,应选酸式滴定管,只有图b合理;图中消耗高锰酸钾的体积为20.80mL-0.80mL=20.00mL,由2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O可知,K3[Fe(C2O4)3]xH2O物质的量为0.02L×0.05mol/L×![]() ×
× ![]() ×
×![]() =0.0033mol,M=
=0.0033mol,M=![]() =496g/mol,则39×3+(56+280×3)+18x=496,解得x=3。
=496g/mol,则39×3+(56+280×3)+18x=496,解得x=3。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案【题目】下列离子方程式的书写及评价,均合理的是
选项 | 离子方程式 | 评价 |
A | 用铜电极电解饱和KCl溶液:2H2O+2Cl- | 正确:Cl-的失电子能力比OH-强 |
B | 向CuSO4溶液中通入过量的H2S气体:Cu2++H2S=CuS↓+2H+ | 错误:H2S的酸性比H2SO4弱 |
C | Ba(HCO3)2溶液与足量的NaOH溶液反应:Ba2++HCO3- +OH- ═BaCO3↓+H2O | 错误:Ba2+与HCO3-系数比应为1:2 |
D | 过量SO2通入到NaClO溶液中:SO2+ClO- +H2O= HClO+HSO3- | 正确:H2SO3的酸性比HClO强 |
A.AB.BC.CD.D