题目内容
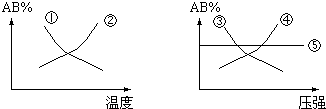
20. 常温下饱和CO2溶液的pH约为5.6.向某未知浓度的Na2CO3溶液中滴入已知浓度的盐酸时,用 pH传感器测得混合溶液的pH变化曲线如图所示,下列说法正确的是( )
常温下饱和CO2溶液的pH约为5.6.向某未知浓度的Na2CO3溶液中滴入已知浓度的盐酸时,用 pH传感器测得混合溶液的pH变化曲线如图所示,下列说法正确的是( )| A. | 该Na2CO3溶液的浓度为0.001mol/L | |
| B. | 在pH=7时,c(Na+)>c(Cl-) | |
| C. | 在pH=6时,c(Na+)>c(CO32-)>c(HCO3-) | |
| D. | c→d发生的主要离子反应为:CO32-+H+=HCO3- |
分析 A.碳酸钠是强碱弱酸盐,碳酸根离子水解而使其溶液呈碱性,但水解程度较小;
B.pH=7,溶液呈中性,则[H+]=[OH-],结合电荷守恒判断;
C.pH=6时,溶液呈酸性,溶液中的溶质为氯化钠、碳酸氢钠和碳酸,且碳酸的电离程度大于碳酸氢钠的水解程度;
D.c→d时,碳酸氢根离子和氢离子发生离子反应生成水和二氧化碳.
解答 解:A.碳酸钠是强碱弱酸盐,碳酸根离子水解而使其溶液呈碱性,但水解程度较小,所以氢氧根离子浓度小于碳酸钠浓度,则碳酸钠溶液的浓度大于0.001mol•L-1,故A错误;
B.pH=7,溶液呈中性,则c(H+)=c(OH-),溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)+c(Cl-),所以c(Na+)=c(HCO3-)+2c(CO32-)+c(Cl-),则c(Na+)>c(Cl-),故B正确;
C.pH=6时,溶液呈酸性,溶液中的溶质为氯化钠、碳酸氢钠和碳酸,且碳酸的电离程度大于碳酸氢钠的水解程度,所以c(HCO3-)>c(CO32-),且钠离子不水解,结合物料守恒得钠离子浓度最大,所以离子浓度大小顺序是c(Na+)>c(HCO3-)>c(CO32-),故C错误;
D.c→d时,碳酸氢根离子和氢离子发生离子反应生成水和二氧化碳,离子反应方程式为:HCO3-+H+=H2O+CO2↑,故D错误;
故选B.
点评 本题综合考查离子浓度的大小比较,题目难度较大,本题注意分析反应物的物质的量之间的关系,判断反应的程度以及溶液的主要成分是解题的关键,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
11.已知A、B、C、D、E是核电荷数依次增大的五种短周期元素,原子半径按D、E、B、C、A的顺序依次减小,B、E为同主族.下列推断正确的是( )
| A. | A、B、E一定不在同一周期 | B. | D为第二周期元素 | ||
| C. | A、D不可能在同一主族 | D. | B、D可能在同一周期 |
8.下列有关有机物的说法中正确的是( )
| A. | 异丁烷的所有原子都位于同一平面上 | |
| B. | 苯和溴水反应制取溴苯属于加成反应 | |
| C. | 糖类在酸性条件下水解产物均为葡糖糖 | |
| D. | 乙基环己烷的一溴代物有6种 |
15.下列有关物质说法正确的是( )
| A. | 加热NH4Cl只破坏离子键 | |
| B. | N2H4中极性键与非极性键的比值是1:4 | |
| C. | PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构 | |
| D. | 某元素最高价氧化物的水化物和氢化物的化学式分别为H2XO4、H2X |
5.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 用石墨作电极电解饱和食盐水时,若阴极得到2 NA个电子,则阳极产生22.4 L气体 | |
| B. | 2 L 0.05 mol•L-1乙酸溶液中H+数目为0.1 NA | |
| C. | 足量的Cu与含有0.2 mol H2SO4的浓硫酸共热可生成SO2为0.1 NA | |
| D. | 7.8 g Na2S 和Na2O2的混合物中,含有的阴离子数目为0.1 NA |
20.下列气体物质的主要来源及对环境影响相对应关系正确的是( )
| 气体物质 | 主要来源 | 对环境的影响 | |
| A | 二氧化碳 | 化石燃料的燃烧 | 酸雨 |
| B | 二氧化氮 | 汽车尾气的排放 | 光化学烟雾 |
| C | 二氧化硫 | 工厂废气的排放 | 温室效应 |
| D | 一氧化碳 | 含酚醛树脂胶的人造板装饰材料 | 臭氧空洞 |
| A. | A | B. | B | C. | C | D. | D |
1.下列各组混合物无论以何种比例混合,只要总的物质的量一定,完全燃烧时消耗氧气的量是定值的是( )
| A. | C2H4、C2H5OH、HOCH2CH2COOH | B. | CH2O、C2H4O2、C6H12O6 | ||
| C. | C6H6、C5H10、C8H6O2 | D. | H2、CO、CH3OH |